Con l'alimentazione introduciamo un insieme di glucidi, lipidi, proteine che verranno trasformate in molecole semplici nell'apparato digerente per seguire successivamente strade diverse in base alle necessità dell'organismo.
Possiamo riassumere nel seguente schema le principali vie metaboliche, che sono pressoché uguali in tutti gli organismi e ciascuna delle quali richiede enzimi specifici.

Metabolismo dei glucidi

Gli organismi eterotrofi ricavano energia soprattutto dai carboidrati. Con la dieta introducono principalmente polisaccaridi o disaccaridi, che devono essere ridotti in zuccheri semplici, soprattutto glucosio. Questa molecola rappresenta l'unica fonte energetica del cervello e dei globuli rossi umani. Le cellule richiedono continuamente glucosio ma l'alimentazione non è continua. Per questo il glucosio è coinvolto in diversi processi per la sua biosintesi o degradazione.
Glicolisi, fermentazione, Ciclo di Krebs
Di queste tre vie cataboliche abbiamo già trattato ampiamente in precedenza.
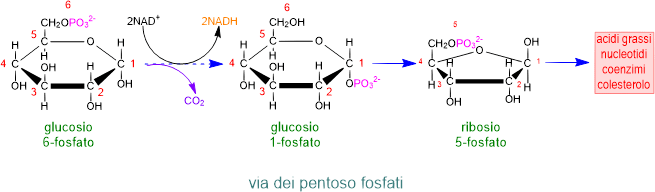
Via del pentoso fosfato
Si tratta di una via parallela alla glicolisi in cui il glucosio 6-fosfato (prima tappa della glicolisi), mediante l'ossidazione di un carbonio, viene trasformato in un pentoso (ribosio 5-fosfato) liberando CO2 e producendo NADPH nei tessuti dove c'è sintesi di acidi grassi. Il ribosio 5-fosfato non è impiegato per produrre ATP ma nella sintesi di acidi grassi, alcuni nucleotidi, colesterolo e coenzimi. Partecipa anche alla formazione del glucosio nella fotosintesi. La via è attiva soprattutto nel tessuto adiposo e in quelle cellule che si riproducono rapidamente come quelle del midollo osseo e tumorali.
Glicogenolisi
La glicogenolisi è l'idrolisi enzimatica del glicogeno presente nelle cellule del fegato e dei muscoli. L'enzima glicogeno fosforilasi stacca i monomeri terminali di glucosio 1-fosfato dal glicogeno (nelle ramificazioni interviene l'enzima deramificante) e poi glucosio 6-fosfato, ottenendo molecole già attivate perciò non è richiesto l'intervento dell'ATP.
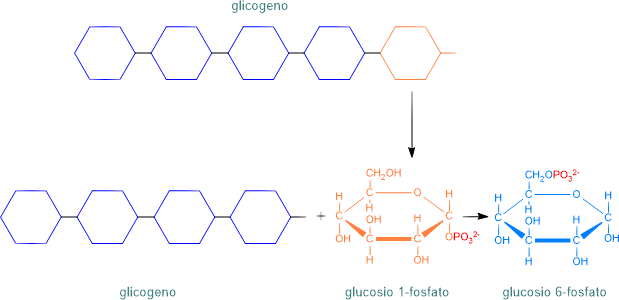
Glicogenosintesi
La glicogenosintesi, o glicogenesi, è la via anabolica che polimerizza il glucosio in glicogeno negli animali, con consumo di energia. Nel fegato rappresenta una fonte di riserva del glucosio mentre nei muscoli scheletrici è impiegato per produrre ATP.
Nel citosol delle cellule epatiche e muscolari il glucosio 6-fosfato in eccesso, ottenuto nella prima tappa della glicolisi, è prima convertito in glucosio 1-fosfato e poi, con specifici enzimi, aggiunge monomeri alla catena di glicogeno preesistente con legami a-1-4 e, con l'enzima ramificante, in a-1-6.

Gluconeogenesi
La gluconeogenesi, è un processo endoergonico di sintesi di glucosio nel citoplasma delle cellule del fegato, dei muscoli e dei reni a partire da molecole non glucidiche come l'acido piruvico, gli amminoacidi ecc., percorrendo parzialmente in senso inverso la glicolisi, quando le riserve di glucosio sono esaurite. Anche l'acido lattico proveniente dai muscoli, quando l'organismo dispone di quantità sufficienti di ossigeno per pagare il "debito di ossigeno", è riconvertito in glucosio e poi portato nel fegato dove viene trasformato in glicogeno. Questa via metabolica è sostenuta dalla ß-ossidazione degli acidi grassi, trattata qui sotto, in quanto fornisce ATP, NADH e acetil-CoA.
Fotosintesi
Anche di questa via ne abbiamo discusso ampiamente.
Metabolismo dei lipidi
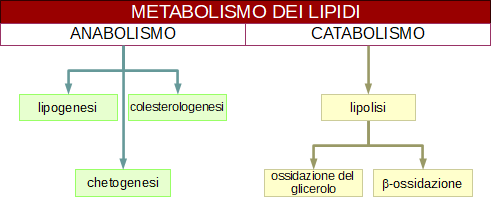
I lipidi, in particolare i trigliceridi, sono una importante fonte energetica negli animali e nelle piante superiori perché possono essere immagazzinati in grande quantità nei tessuti in forma anidra e liberano un'energia più che doppia rispetto ai glucidi.
Lipolisi
Quando l'organismo affronta un digiuno prolungato mobilizza i trigliceridi presenti nel tessuto adiposo.
I lipidi vengono innanzitutto emulsionati e poi idrolizzati dall'enzima lipasi in acidi grassi e glicerolo nel citosol dei muscoli e del miocardio.
Ossidazione del glicerolo
Il glicerolo è prima attivato dall'ATP e poi convertito in gliceraldeide 3-fosfato (G3P), ossidato dal NAD+ in diidrossiacetone fosfato, intermedio della glicolisi, con formazione di NADH + H+. Questa molecola può essere trasformata in acido piruvico ed entrare nel ciclo di Krebs oppure in glicogeno nel fegato (via metabolica dei glucidi).

Ossidazione degli acidi grassi
Gli acidi grassi subiscono la demolizione catabolica, detta ß-ossidazione, secondo le seguenti tappe.
- Gli acidi grassi sono attivati dall'unione con il CoA e formano acil-CoA (reazione endoergonica). Sono poi trasportati nella matrice del mitocondrio da un complesso proteico, la carnitina, dove ha luogo l'ossidazione in quattro reazioni successive:
- ossidazione dell'acil-CoA da parte del FAD,
- idratazione,
- ossidazione da parte del NAD+,
- idrolisi e formazione di una molecola di acetil-CoA e una di acil-CoA con due carboni in meno.
- Le molecole di acetil-CoA prodotte entrano nel ciclo di Krebs, sempre nella matrice mitocondriale, e sono ossidate a CO2. L'inserimento è condizionato dalla presenza adeguata di acido piruvico proveniente dalla glicolisi.
- Gli elettroni derivanti dall'ossidazione entrano nella catena respiratoria trasportati dal NADH e FADH2 e riducono l'ossigeno in acqua e liberano energia per la sintesi di ATP.
La ß-ossidazione degli acidi grassi comporta un ricavo energetico di 44 APT contro 36 ATP derivanti dalla degradazione del glucosio e quindi è la fonte energetica della maggior parte dei tessuti.

Chetogenesi
Una parte dell'acetil-CoA prodotto dall'ossidazione degli acidi grassi, invece di entrare nel ciclo di Krebs è trasformata in corpi chetonici: acetoacetato, ß-idrossibutirrato e acetone, che sono importanti fonti energetiche per i tessuti periferici quando c'è carenza di glucosio o un suo alterato metabolismo. Il processo avviene nei mitocondri delle cellule epatiche e i prodotti sono utilizzati nel cuore, nei muscoli e nel cervello. Questo processo permette di liberare CoA rendendolo disponibile per i processi che lo richiedono.

Lipogenesi
L'acetil-CoA è il punto di arrivo della demolizione degli acidi grassi - ma può derivare anche dal metabolismo di glucidi e proteine - e il punto di partenza per la loro sintesi (tranne per gli acidi grassi essenziali).
La lipogenesi è la conversione dell'eccesso di glucosio in acidi grassi. Si attua principalmente nel tessuto adiposo, ma anche nel fegato, a partire dall'acetil-CoA con un processo inverso a quello della degradazione, ma le reazioni si svolgono in comparti diversi della cellula: nel citosol delle cellule animali e nel cloroplasto di quelle vegetali. Ulteriori modifiche avvengono nel reticolo endoplasmatico liscio. Il processo richiede una grande quantità di energia libera immagazzinata nell'ATP.
Il processo consiste in:
- condensazione di molecole di acetil-CoA,
- riduzione mediante NADPH,
- disidratazione,
- ulteriore riduzione dal NADPH.
Gli acidi grassi non si accumulano nella cellula ma, appena formati o assunti, sono incorporati nei trigliceridi e nei fosfolipidi e accumulati nel tessuto adiposo ma anche nei semi e nei frutti di molte piante. Questo impedisce l'azione detergente degli acidi grassi liberi.
Metabolismo delle proteine e degli amminoacidi

Le proteine rappresentano circa il 15% del peso di un individuo adulto. Esse devono continuamente essere rinnovate in sostituzione di quelle danneggiate e, inoltre, sono importanti componenti di regolazione. Le proteine non formano accumuli di riserva energetica nei tessuti o negli organi come per il glicogeno o i trigliceridi tuttavia in caso di denutrizione o di alimentazione esclusivamente proteica possono essere utilizzate per produrre energia.
Proteolisi
Le proteine introdotte con la dieta hanno una composizione diversa in amminoacidi rispetto a quelle presenti nell'organismo, perciò devono essere idrolizzate in oligopeptidi e poi in amminoacidi da enzimi specifici (proteasi) prodotti dallo stomaco, dal pancreas e dal duodeno. La proteolisi avviene all'interno dei lisosomi, in particolare nel fegato e muscoli.
Le proteine sono in seguito ricostruite in base alle necessità, mentre gli amminoacidi in eccesso sono catabolizzati a scopo energetico.
Ricordiamo che gli amminoacidi hanno uno scheletro carbonioso e un gruppo amminico, che seguono vie metaboliche diverse.
Metabolismo del gruppo amminico degli amminoacidi
La prima reazione del metabolismo degli amminoacidi consiste nella transaminazione di -NH2, cioè il suo trasferimento, grazie alle transaminasi, a un chetoacido (in genere all'acido a-chetoglutarico, prodotto intermedio del ciclo di Krebs) con formazione di una molecola di acido glutammico e una di un nuovo a-chetoacido.
Le reazioni di transaminazione sono molto importanti perché permettono l'interconversione degli amminoacidi secondo le richieste dell'organismo, oppure sono utilizzati per produrre energia.

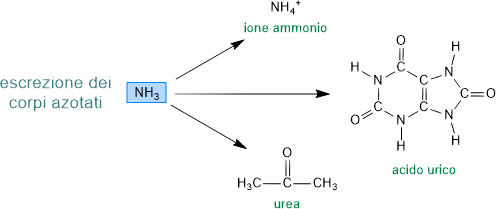
L'acido glutammico entra nei mitocondri delle cellule epatiche e renali, dove può subire la deaminazione ossidativa, cioè la rimozione diretta del gruppo amminico per rigenerare l'acido a-chetoglutarico e liberare una molecola di NH3.

L'ammoniaca, molecola tossica per la cellula, può essere trasformata ed eliminata direttamente sotto forma di ione ammonio o dopo essere stata convertita in un altro composto azotato come l'acido urico o l'urea a seconda della specie animale.
L'a-chetoacido può entrare nel ciclo di Krebs, può essere trasformato in gliocogeno o grassi, può servire alla biosintesi di molecole mediante transaminazione.
Metabolismo dello scheletro carbonioso degli amminoacidi
Lo scheletro carbonioso rimasto dopo la transaminazione è demolito principalmente nel fegato con vie metaboliche proprie di ciascun amminoacido e utilizzato per produrre energia nelle seguenti modalità.
- Alcuni amminoacidi sono convertiti in acido piruvico o composti intermedi del ciclo di Krebs e quindi seguono la via della gluconeogenesi (amminoacidi glucogenici).
- Un'altra parte è convertita in acetoacetato e sono quindi chetogenici, cioè formano corpi chetonici o intermedi convertiti in acetil-CoA e seguire le vie metaboliche in cui è coinvolto (es. acidi grassi).
- Infine, alcuni possono seguire l'una o l'altra via secondo le esigenze dell'organismo.
Decarbossilazione degli amminoacidi
La decarbossilazione, cioè la rimozione del gruppo -COOH, è la terza via del catabolismo degli amminoacidi e produce la corrispondente ammina, con liberazione di CO2.

Sintesi proteica
Le proteine sono continuamente sintetizzate dai ribosomi nel reticolo endoplasmatico rugoso (e il processo sarà trattato in altra sezione).
Sintesi di amminoacidi non essenziali
Gli amminoacidi non essenziali sono sintetizzati a partire da composti intermedi della glicolisi e del ciclo di Krebs, mediante transaminazione del gruppo -NH2 da un amminoacido disponibile a un chetoacido che produrrà l'amminoacido di cui c'è necessità.
La sintesi riguarda soprattutto piante e microrganismi perché negli animali una dieta corretta contiene gli amminoacidi necessari. Inoltre, per la biosintesi è richiesta una grande quantità di energia, superiore rispetto a quella che si ricava dalla demolizione.
Gli amminoacidi essenziali devono invece essere necessariamente introdotti con la dieta.

