I composti aromatici sono idrocarburi derivati dal benzene, un idrocarburo ciclico.
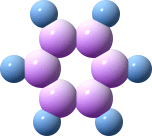
La formula grezza è C6H6, con gli atomi di carbonio ibridati sp2, perciò si forma una struttura planare esagonale con angoli di legame di 120°.


I 6 orbitali p non ibridati formano 3 doppi legami da cui derivano due diverse strutture di risonanza:
 |  |
In realtà, gli elettroni di questi orbitali si distribuiscono uniformemente su tutta la molecola formando un anello elettronico sopra e sotto il piano (delocalizzazione), rendendo il benzene particolarmente stabile (aromaticità).

Esso viene rappresentato in questo modo:
 | o più semplicemente: |  |
Il radicale che si ottiene togliendo un idrogeno al benzene è detto fenile.

Derivati del benzene di particolare interesse, detti complessivamente areni, sono:
 |  |  |  |  |  |
naftalene (naftalina) | metilbenzene (toluene) | vinilbenzene (stirene) | fenolo | anilina | acido benzoico |
Proprietà fisiche e chimiche
Gli idrocarburi aromatici sono composti non polari insolubili in acqua, sulla quale galleggiano a causa della bassa densità.
Il benzene è impiegato per la produzione di materie plastiche, fibre sintetiche, benzina; la naftalina si usa come antitarme; il toluene è un solvente di composti non polari; lo stirene è impiegato nella preparazione del polistirolo; il fenolo è utilizzato come composto di partenza per molti prodotti industriali; l'acido benzoico si usa come antifermentativo e conservante.
In generale, come combustibili e come solventi sono scarsamente impiegati, mentre trovano largo impiego come materia prima per la sintesi di: coloranti, materie plastiche, essenze, insetticidi, antiparassitari, detersivi, prodotti farmaceutici ecc.
Addizione
Le reazioni di addizione sono possibili solo ad alta temperatura o con i raggi UV e con gli alogeni dà i corrispondenti alogeno-cicloalcani. 
Sostituzione
Le reazioni di sostituzione sono spontanee ma richiedono la presenza di un catalizzatore.
Alogenazione

clorobenzene
Nitrazione

nitrobenzene
Solfonazione

acido benzensolfonico
Alchilazione

metilbenzene
Quando si sostituiscono due H, è necessario specificare la posizione dei sostituenti:
orto (1,2-) prefisso o- meta (1,3-) m- para (1,4-) p-
 | 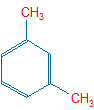 |  |
o-dimetil-benzene | m-dimetil-benzene | p-dimetil-benzene |

