Gli alcani sono idrocarburi saturi, cioè formati soltanto da legami semplici, con formula generale
![]()
dove n è il numero di atomi di carbonio del composto.
Il carbonio è ibridato sp3, perciò la molecola è disposta secondo il tetraedro (angoli di 109.5°).

I primi quattro composti hanno nomi propri (metano, etano, propano, butano), mentre i successivi sono denominati con un prefisso che indica il numero di atomi di carbonio, seguito dal suffisso -ano (pentano, esano, ecc.).
| Nome | Formula grezza | Formula di struttura | Formula razionale | Modello tridimensionale |
|---|---|---|---|---|
| metano |  | 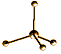 | ||
| etano |  |  | ||
| propano |  |  | ||
| butano |  | 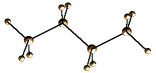 |
Metano, etano, propano presentano una sola formula di struttura, mentre a partire dal butano sono possibili strutture diverse, cioè il composto presenta degli isomeri (isomeria di catena).
Ad esempio, per il butano sono possibili queste due strutture:
 | |
n-butano | isobutano |
Se dalla molecola dell'idrocarburo si toglie un idrogeno si ottiene un radicale alchilico il cui nome deriva dall'idrocarburo sostituendo al suffisso -ano il suffisso -ile.
| CH3 metile |
|
|
|
|
|

|
Per gli ultimi tre:
- n-butile su un carbonio primario (legato a 1 altro C)
- sec-butile su un carbonio secondario (legato a 2 altri C)
- terz-butile su un carbonio terziario (legato a 3 altri C)
Per la classificazione degli idrocarburi complessi si veda più avanti.
Proprietà fisiche e chimiche
I primi quattro idrocarburi sono gas incolori, tra C5 e C18 sono liquidi, e i successivi sono solidi a temperatura ambiente. Le temperature di fusione, di ebollizione e la densità dipendono dalla lunghezza e dalle ramificazioni della catena di atomi di carbonio.
Sono anche composti molto stabili, cioè hanno scarsa tendenza a reagire con altre sostanze, per questo sono detti paraffine (poco affini), infatti, sono idrofobi, insolubili in acqua ma solubili in composti non polari come il benzene, in condizioni normali non reagiscono né con gli acidi, né con le basi, né con agenti ossidanti. La loro stabilità è dovuta ai legami covalenti puri e alla disposizione simmetrica degli atomi di idrogeno. Tuttavia, in particolari condizioni o in presenza di catalizzatori, gli alcani possono dare tre tipi di reazioni: sostituzione radicalica, combustione, cracking.
La principale fonte degli alcani è il petrolio; poiché bruciano facilmente, sono impiegati come carburanti, combustibili e, in genere, come fonti di energia. Il metano, gas incolore e inodore, si forma dalla decomposizione di sostanze organiche nelle zone paludose. Propano e butano sono facilmente liquefabili e sono venduti in bombole come G.P.L.
Sostituzione radicalica
La sostituzione radicalica consiste nella sostituzione di uno o più atomi di idrogeno con altri atomi o gruppi atomici. In particolare, se l'atomo che sostituisce l'idrogeno è un alogeno, si ha una reazione di alogenazione.

L'esperienza dimostra che negli alcani la sostituzione di un idrogeno legato ad un atomo di carbonio terziario è più facile di quella di un idrogeno legato a un atomo di carbonio secondario e questa, a sua volta, è più facile della sostituzione di un idrogeno legato a un atomo di carbonio primario.
Gli alogenuri alchilici sono più reattivi degli alcani perché l'atomo X, se ha elettronegatività diversa da C, forma un legame polarizzato con spostamento di elettroni verso l'atomo più elettronegativo (delocalizzazione elettronica).
Se X è più elettronegativo di C, e ha un orbitale vuoto, attira gli elettroni e viene detto elettrofilo; se è meno elettronegativo di C, e ha un doppietto elettronico disponibile, tende a cedere elettroni e viene detto nucleofilo.
In una catena di atomi di carbonio, la polarizzazione non si limita al legame C - X, ma provoca un effetto induttivo comunicandosi ai legami σ vicini, che ne vengono indeboliti. Per questo motivo gli alogenoderivati danno facilmente altre reazioni di sostituzione.
Combustione
Quasi tutti gli alcani possono essere utilizzati come combustibili liquidi o gassosi.
La reazione di combustione in presenza di ossigeno non è spontanea a temperatura ambiente, ma deve essere innescata, ad esempio con una fiamma. Dalla reazione si forma anidride carbonica e acqua con liberazione di una grande quantità di energia.
![]()
Cracking
Gli idrocarburi si ricavano da petrolio greggio che contiene in superficie idrocarburi gassosi, mentre la miscela liquida sottostante viene estratta e separata per distillazione, basandosi sul diverso punto di ebollizione dei componenti.
Il processo che spezza in due o più parti la catena di un idrocarburo è detto cracking e, a causa della grande stabilità dei legami σ tra gli atomi di carbonio, richiede notevoli quantità di energia oppure l'uso di catalizzatori.
Cicloalcani
Gli idrocarburi alifatici a catena chiusa hanno proprietà simili ai corrispondenti termini a catena aperta.
Il nome deriva dal corrispondente idrocarburi aggiungendo il prefisso ciclo.
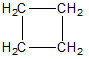
I composti più diffusi sono i cicloalcani, che derivano dagli alcani per chiusura ad anello delle due estremità con eliminazione di due H, perciò la formula generale è CnH2n.
 | ciclopropano |
 | ciclobutano |
 | ciclopentano |
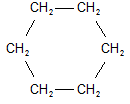 | cicloesano |
Il cicloesano è impiegato per la fabbricazione del nailon.

