Il legame e l'energia
In natura, come atomi isolati esistono solo i gas nobili, mentre gli altri si combinano per formare molecole di elementi o di composti.
Il legame chimico è la forza che tiene uniti gli atomi nei composti.
Il legame si forma se l'energia complessiva della molecola è inferiore a quella degli atomi separati.
Il composto che si ottiene ha perciò un contenuto energetico minore rispetto agli atomi di partenza, perciò ha una maggiore stabilità.
L'energia di legame è la quantità di energia che si libera quando si forma un legame e che occorre per rompere un legame.
Teoria dell'ottetto
Lewis nel 1916 formulò una prima teoria che identifica gli elettroni del livello più esterno, elettroni di valenza, i responsabili della formazione dei legami.
Avendo notato che gli elementi che avevano otto elettroni nel livello più esterno, escluso l'elio, (gas nobili), erano particolarmente stabili, formulò la regola dell'ottetto:
Gli atomi che presentano elettroni spaiati tendono a raggiungere la configurazione stabile nel livello più esterno (ottetto) mediante la perdita, l'acquisto o la condivisione degli elettroni, per questo si uniscono con altri atomi per formare molecole.
![]()
Teoria del legame di valenza (VB)
La teoria dell'ottetto è di facile applicazione ma presenta alcune lacune; non spiega, infatti, perché alcune molecole sono ugualmente stabili senza avere il livello più esterno completo.
Pauling ha proposta la teoria del legame di valenza, secondo la quale le molecole possono essere ugualmente stabili se non ci sono elettroni spaiati, cioè se si ha la sovrapposizione degli orbitali semioccupati.
![]()
Dalla sovrapposizione di due orbitali atomici, che avviene lungo l'asse dei nuclei, si forma un orbitale molecolare nel quale si muove la coppia di elettroni.

Teoria degli orbitali molecolari (MO)
Alcune molecole, come quella dell'ossigeno, presentano proprietà non spiegabili con la teoria VB. È stato allora proposto un nuovo modello degli orbitali molecolari.
Dall'unione di orbitali atomici si ottiene un uguale numero di orbitali molecolari che non appartengono ad un solo atomo ma all'intera molecola.
Diversamente dalla teoria VB, dalla sovrapposizione di 2 orbitali atomici si ottengono due orbitali molecolari e non uno soltanto, uno a energia inferiore rispetto agli orbitali di partenza, detto orbitale di legame e l'altro ad energia superiore, detto orbitale di antilegame (asteriscato). Il primo presenta l'addensamento elettronico tra i due nuclei e l'altro all'esterno di essi.
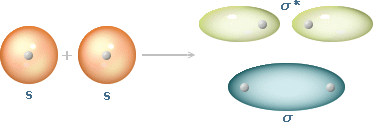
Ecco l'esempio della formazione della molecola di idrogeno.

Tipi di legame
Per ottenere l'ottetto o gli elettroni in coppie, si stabiliscono legami che possono essere di natura diversa in base alla differenza di elettronegatività tra gli atomi e alle caratteristiche degli elementi stessi.


