Si intende per materia tutto ciò che esiste nell'Universo, occupa uno spazio, ha una massa e possiede energia.
La porzione di materia che può essere descritta e misurata si chiama corpo.
La materia si presenta sotto forma di diversi generi, che si chiamano sostanze, le quali in ogni loro parte presentano le stesse e definite proprietà chimiche e fisiche.
I corpi possono essere costituiti da sostanze pure o da miscele, cioè dall'unione di due o più sostanze pure.
La sostanza pura è quella parte di materia non separabile in altre sostanze con trasformazioni fisiche, formata da un unico tipo di particelle tutte uguali e con composizione fissa e ben definita, che si ripete in ogni punto.
Le sostanze pure si definiscono elementi quando non possono essere ulteriormente scomposte, e composti quando si possono dividere in due o più elementi mediante una trasformazione chimica. Il ferro, il carbonio, l’ossigeno sono esempi di elementi, mentre l’acqua e lo zucchero sono composti.
Le miscele possono dividersi in miscele omogenee (soluzioni), quando i componenti hanno le particelle distribuite in modo uniforme per cui non sono più distinguibili, presentano una sola fase, (porzione di materia fisicamente distinguibile, separata da una superficie definita e con proprietà costanti in ogni punto) e ogni parte ha sempre le stesse proprietà. Ne sono esempi l'aria o una soluzione salina.
Le miscele eterogenee o miscugli, invece, hanno le particelle distribuite in modo non omogeneo, i diversi componenti si possono distinguere e presentano due o più fasi e le proprietà variano da un punto all'altro del campione. Il latte, ad esempio, è un miscuglio eterogeneo contenente acqua e piccole gocce di grasso.

Separazione di miscele
Poiché i componenti di una miscela mantengono le proprie caratteristiche, è possibile separarli con opportuni mezzi.
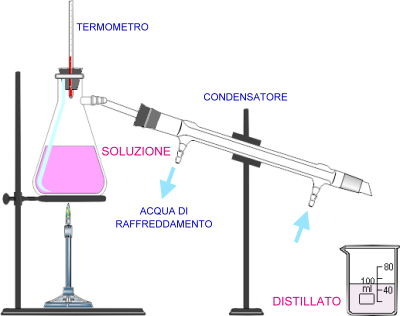
Distillazione. Si usa per separare miscele omogenee liquido-solido o liquido-liquido, sfruttando il diverso punto di ebollizione. Nel primo caso si fa bollire la soluzione e il vapore che si forma viene fatto condensare e raccolto (distillato). Nel recipiente di distillazione rimane il soluto. Nel secondo caso, specialmente se i punti di ebollizione sono molto vicini, si opera mediante distillazione frazionata.
Cromatografia. Si fa assorbire la miscela omogenea su una carta porosa e poi si immerge l'estremità della carta in un apposito eluente. Risalendo, l'eluente trascina con sé i componenti della miscela a diverse velocità, perciò si ottiene una separazione.

Cristallizzazione. Si separano i componenti di una miscela omogenea sfruttando la diversa solubilità. Si fa evaporare il solvente finché la soluzione diventa satura del componente meno solubile, che si separa sotto forma di cristalli. Si procede poi nella concentrazione per separare gli altri soluti.

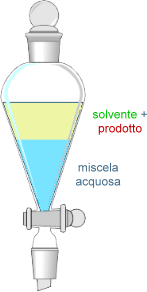
Estrazione con solventi. Sfruttando la diversa solubilità dei componenti di una miscela eterogenea liquido-liquido, si introduce il solvente in un miscuglio; questo scioglierà solo uno dei componenti permettendone la separazione. Si fa poi evaporare il solvente.
Filtrazione. Si separano i componenti di una miscela eterogenea solido-liquido sfruttando la differenza di dimensione delle particelle, facendo passare il miscuglio attraverso un setto poroso.

Centrifugazione. Si usa per separare i componenti di una miscela eterogenea aventi piccole differenze di densità. Facendo ruotare velocemente la soluzione all'interno di un contenitore posto in una centrifuga, si ottiene una stratificazione in base alla densità.
Decantazione. Se c'è una grande differenza di densità tra i componenti solidi e liquidi di una miscela eterogenea, è possibile separarli semplicemente facendo riposare la miscela in modo che il soluto sospeso si depositi sul fondo (sedimentazione).
Stati di aggregazione
La materia può avere tre stati di aggregazione, spiegabili con la teoria cinetico-corpuscolare.
Si ritiene che la materia sia costituita da piccolissime particelle dotate di energia cinetica, cioè si muovono continuamente. Le particelle sono attirate le une dalle altre da forze di coesione che tendono a mantenerle vicine, mentre l'energia cinetica tende ad allontanarle. Il prevalere di una o dell'altra forza determina lo stato fisico di aggregazione, che è specifico di ogni sostanza a determinate condizioni di pressione e temperatura.
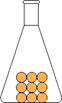 solido: le particelle sono molto vicine e occupano uno spazio definito e fisso; a causa delle elevate forze di coesione possono solamente oscillare, perciò il solido ha un volume e una forma propria, una densità alta e una bassa dilatazione termica: un aumento di pressione ha un effetto praticamente nullo sul volume, il solido è cioè incomprimibile.
solido: le particelle sono molto vicine e occupano uno spazio definito e fisso; a causa delle elevate forze di coesione possono solamente oscillare, perciò il solido ha un volume e una forma propria, una densità alta e una bassa dilatazione termica: un aumento di pressione ha un effetto praticamente nullo sul volume, il solido è cioè incomprimibile.
Lo stato solido cristallino si ha quando le sostanze assumono una forma poliedrica, anche se irregolare. Quando le particelle assumono una forma disordinata si parla di solido amorfo e, anche se le particelle non possono muoversi, si può considerare liquido ad altissima viscosità.
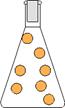
 liquido: le particelle sono meno vicine rispetto allo stato solido e hanno una minore forza di coesione, per cui possono scorrere; di conseguenza, la materia ha un volume proprio ma la forma del recipiente che la contiene; ha una media densità e media dilatazione termica; all'aumento della pressione, la diminuzione di volume è trascurabile e quindi il liquido è praticamente incomprimibile.
liquido: le particelle sono meno vicine rispetto allo stato solido e hanno una minore forza di coesione, per cui possono scorrere; di conseguenza, la materia ha un volume proprio ma la forma del recipiente che la contiene; ha una media densità e media dilatazione termica; all'aumento della pressione, la diminuzione di volume è trascurabile e quindi il liquido è praticamente incomprimibile.
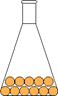
 aeriforme: le particelle sono separate e in continuo rapido movimento, per cui la materia assume forma e volume del recipiente che lo contiene; ha una bassa densità ed elevata dilatazione termica; con l'aumentare della pressione il volume diminuisce sensibilmente.
aeriforme: le particelle sono separate e in continuo rapido movimento, per cui la materia assume forma e volume del recipiente che lo contiene; ha una bassa densità ed elevata dilatazione termica; con l'aumentare della pressione il volume diminuisce sensibilmente.
I corpi allo stato aeriforme si distinguono in vapori e gas: i primi sono sostanze che a temperatura ambiente esistono come solidi (naftalina) o liquidi (alcool), mentre i gas a temperatura ambiente esistono solo come aeriformi.
Liquidi e aeriformi sono chiamati fluidi per la loro capacità di scorrere e di assumere la forma del recipiente.

