La velocità di reazione è definita come la variazione di concentrazione [ ] dei reagenti (reagente consumato) o dei prodotti (prodotto formato) con il passare del tempo.
[R1]+[R2] → [P1]+[P2]
![]()
V = k [R1][R2]
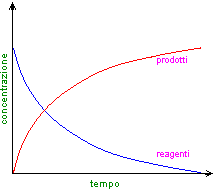
La velocità di una reazione non è costante, ma diminuisce nel tempo perché i reagenti progressivamente si consumano.

Conoscere il tempo necessario perché avvenga una reazione è molto importante, soprattutto per l'industria. Esistono infatti reazioni praticamente istantanee, come un'esplosione; alcune avvengono in minuti o ore, cioè a velocità moderata; altre sono molto lente, come la formazione del carbone, che impiega milioni di anni.
Teoria degli urti
Affinché una reazione spontanea si verifichi, le molecole dei reagenti devono essere soddisfatte le seguenti condizioni.
- Frequenza delle collisioni. Più elevate sono la temperatura e la concentrazione, maggiore è la probabilità che le particelle si scontrino.
- Orientamento. Le particelle devono urtarsi in una direzione favorevole e con sufficiente energia, gli urti devono cioè essere efficaci.

- Energia di attivazione. È l'energia minima che occorre fornire all'inizio per avviare la reazione. Quando l'energia di attivazione è molto alta, la reazione avviene molto lentamente e questo dipende dal tipo di reagente.

Ad esempio, il metano reagisce spontaneamente con l'ossigeno dell'aria liberando una grande quantità di energia sotto forma di calore, ma possono rimanere a contatto per anni senza che non succeda nulla, finché non si fornisce una scintilla (energia di attivazione) che innesca violentemente la reazione.
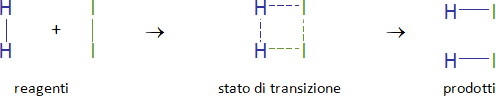
Questa energia è spiegabile con la teoria dello stato di transizione (o del complesso attivato).
Nel passaggio tra reagenti e prodotti si ha una situazione di transizione instabile (e quindi ad alta energia) in cui i legami tra gli atomi dei reagenti sono indeboliti e quelli tra gli atomi dei prodotti non si sono ancora completamente formati.
Ad esempio, nella reazione
H2 + I2 → 2HI
abbiamo questa situazione:
Fattori che influenzano la velocità di reazione
La velocità di reazione dipende dai seguenti fattori:
- natura dei reagenti
- concentrazione
- frammentazione dei reagenti
- temperatura
- catalisi
Natura dei reagenti
Una sostanza pura reagisce in modo differente, a parità di condizioni, con sostanze diverse. Ad esempio, l'ossigeno reagisce molto lentamente con il ferro, mentre con il fosforo bianco reagisce istantaneamente. Questo dipende dalla forza dei legami interessati.
Concentrazione
Come abbiamo detto sopra, ci deve essere un numero sufficiente di collisioni con adeguata energia perché possa avvenire la reazione.
Aumentando la concentrazione dei reagenti, aumenta la probabilità di avere urti efficaci e, di conseguenza, la velocità di reazione.
Nel disegno, al raddoppiare della quantità dei reagenti si ha la quadruplicazione del numero di urti.

Frammentazione dei reagenti
L'estensione della superficie di contatto tra i reagenti influenza la velocità della reazione.
Un pezzo di marmo immerso nell'acido cloridrico si dissolve più lentamente rispetto a quello ridotto in scaglie o in polvere.

Temperatura
All'aumentare della temperatura le molecole si agitano maggiormente rendendo più frequenti le collisioni e quindi aumentando la velocità delle reazioni.
Catalisi
Una reazione spontanea per poter avvenire ha bisogno di superare la barriera energetica costituita dall'energia di attivazione.
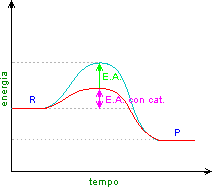
La presenza di un catalizzatore abbassa l'energia di attivazione aumentando la velocità di reazione.
Il catalizzatore è una sostanza (atomo, ione o molecola) che messa insieme ai reagenti si ritrova inalterato alla fine della reazione.
Generalmente, il catalizzatore agisce legandosi temporaneamente a uno dei reagenti, indebolendone i legami, perciò lo predispone all'interazione con l'altro reagente.
Si ha una catalisi omogenea quando il catalizzatore si trova nella stessa fase dei reagenti e catalisi eterogenea quando si trovano in fasi diverse.

