Il legame ionico è un legame di natura elettrostatica tra ioni di segno opposto.
Si forma quando due atomi presentano una differenza di elettronegatività superiore a 1.9; in questo caso, un elettrone di un elemento viene strappato e trasferito all'elemento più elettronegativo: l'atomo che perde l'elettrone diventa uno ione positivo, mentre quello che lo acquista diventa uno ione negativo. I due ioni poi vengono attirati da forze elettrostatiche.
Ad esempio:
![]()
Il sodio ha un elettrone nel livello più esterno e una elettronegatività di 0.9; per raggiungere l'ottetto è più facile, vista la bassa energia di ionizzazione, che perda un elettrone piuttosto che ne acquisti 7.
Il cloro ha 7 elettroni nel livello più esterno e un'elettronegatività pari a 3; per l'alta energia di ionizzazione egli può acquistare più facilmente un elettrone che perderne 7.
Poiché tra i due atomi c'è una differenza di elettronegatività di 2.1, l'elettrone di Na non viene condiviso con Cl come nel legame covalente, ma è trasferito da Na a Cl, diventando rispettivamente Na+ e Cl-.

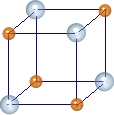
In realtà, ogni ione positivo è circondato da diversi ioni negativi e viceversa, in modo da formare un reticolo cristallino tipico dei sali, caratterizzati da durezza ma, contemporaneamente da fragilità, oltre che da elevata solubilità in acqua.
Complessivamente, un composto ionico, pur essendo formato da ioni, è neutro dal punto di vista elettrico.