Nella reazione spontanea del primo esempio gli elettroni sono passati direttamente dalla lamina di zinco agli ioni rame della soluzione. Se gli elettroni sono invece costretti a passare lungo un filo metallico, è possibile ricavare energia elettrica. Questo si può ottenere con la pila Daniell.
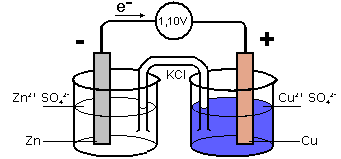
In un recipiente (prima semicella) contenente una soluzione 1 M di ZnSO4 si immerge una lamina di Zn (primo elettrodo). In un altro recipiente (seconda semicella) si inserisce una lamina di Cu (secondo elettrodo) immersa in una soluzione 1 M di CuSO4.
Si collegano le due lamine con un filo metallico al quale si interpone un rilevatore di corrente (es. voltmetro o lampadina), e si chiude il circuito con un ponte costituito da un tubo a U, chiuso da due batuffoli di cotone, contenente una soluzione salina (es. KCl), che permette lo spostamento di ioni. In alternativa al ponte si può utilizzare un setto poroso.

La lamina di Zn rilascia ioni Zn2+ che vanno in soluzione (ossidazione) liberando una coppia di elettroni che si accumulano sulla lamina creando il polo negativo della pila (anodo). L'elettrodo perciò progressivamente si consuma.
Gli elettroni, attraverso il filo metallico, arrivano alla lamina di Cu dove vengono presi dagli ioni Cu2+ della soluzioni (riduzione), formando Cu metallico che si deposita sulla lamina stessa ingrossandola.
È il polo positivo o catodo.
Nella prima soluzione c'è un eccesso di ioni positivi, mentre c'è una carenza degli stessi ioni nella seconda soluzione; la differenza è riequilibrata dal passaggio di ioni SO42- dal secondo al primo recipiente attraverso il ponte salino, oppure lo spostamento di ioni K+ e Cl-.
Riassumendo:
All'anodo ![]() c'è stata una ossidazione:
c'è stata una ossidazione:
Al catodo ![]() c'è stata una riduzione:
c'è stata una riduzione:
La reazione complessiva è:
Il flusso ordinato di elettroni che percorre il circuito elettrico dal polo negativo al polo positivo ha generato una corrente elettrica rivelata dall'accensione della lampadina o dall'indicazione del voltmetro. Nell'esperienza precedente, invece, quando i due elementi erano a contatto diretto, l'energia veniva liberata sotto forma di calore.
Possiamo dare ora la definizione di pila.
La pila o cella elettrochimica, è un sistema che produce energia elettrica mediante una redox spontanea, dove all'anodo c'è una ossidazione e al catodo una riduzione.
La pila è schematizzata nel seguente modo:
Anodo ║ Catodo
Zn|Zn2+║ Cu2+|Cu
dove ║ rappresenta il ponte salino o setto poroso.

