In prima approssimazione, i metalli possono considerarsi costituiti da un reticolo dei nuclei atomici circondati dagli elettroni più interni, immersi in un “mare di elettroni” (o gas elettronico), messi in comune a tutta la struttura, che impedisce la repulsione delle cariche positive.
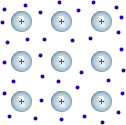
La particolare struttura conferisce le tipiche proprietà dei metalli, come la conduzione di corrente, la lucentezza, la duttilità e la malleabilità.
Questa teoria non spiega tutte le proprietà dei metalli perciò, partendo dalla teoria degli orbitali molecolari, si prevede che si possono ottenere orbitali molecolari a partire da un gran numero di atomi. La combinazione dei loro orbitali atomici porta alla formazione di moltissimi orbitali molecolari con livelli energetici molto ravvicinati, così da costituire una banda accessibile agli elettroni.
Gli elettroni si dispongono nella banda a più bassa energia disponibile. Esiste poi una banda di conduzione, a energia maggiore, formata da orbitali sovrapposti, nella quale si pongono gli elettroni quando si applica la corrente elettrica. In questo modo si propagano in qualsiasi zona del metallo.
Nei non-metalli, tra la banda occupata dagli elettroni e quella di conduzione c'è un'ampia zona proibita, perciò sono isolanti.
Esiste anche una terza condizione, quella dei semiconduttori, in cui la zona proibita è più limitata e gli elettroni, in particolari condizioni, la possono superare.


