I composti, per essere denominati, richiedono l'applicazione di alcune regole secondo la Nomenclatura IUPAC. Per alcuni composti molto comuni si usa ancora la terminologia tradizionale. Nella tabella più sotto sono indicati i principali composti.
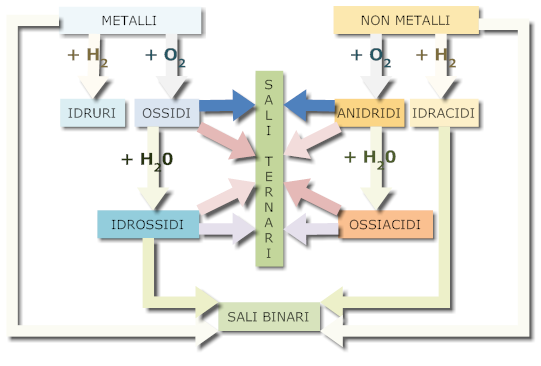
In questa sede accenniamo anche alle modalità con cui si ottengono i composti, che complessivamente è riassunta nella sottostante tabella.
In una reazione, la quantità dei reagenti deve sempre essere uguale a quella dei prodotti; se nella reazione abbiamo atomi in quantità differente tra reagenti e prodotti si procede al bilanciamento.
Per fare questo occorre introdurre due concetti.
Valenza: indica quanti elettroni spaiati possiede l'elemento. Noi la scriviamo con numeri romani sopra l'elemento.
Numero di ossidazione: è la carica apparente che un elemento mostra in un composto. Si scrive il numero e il relativo segno sopra l'elemento.
Per bilanciare correttamente una reazione bisogna conoscere il numero di ossidazione; noi useremo la valenza che, in questa sede, risulta più semplice. Di seguito sono riportate alcune regole per bilanciare i principali composti, insieme alla nomenclatura tradizionale e IUPAC.
Composti binari con l'idrogeno
Idruri
Composti binari derivanti dall'unione dell'idrogeno con un metallo oppure con un non metallo (o semimetallo) non appartenente al gruppo VII.
![]()
Li + H2 → 2LiHidruro di litio
Per i bilanciamenti si vedano le regole degli ossidi.
Idracidi
Sono un particolare tipo di idruri derivanti dall'unione dell'idrogeno con un alogeno o con lo zolfo.
![]()
| Formula | Nome tradizionale | None IUPAC |
|---|---|---|
| HF | acido fluoridrico | Fluoruro di idrogeno |
| HCl | acido cloridrico | cloruro di idrogeno |
| HBr | acido bromidrico | bromuro di idrogeno |
| HI | acido iodidrico | ioduro di idrogeno |
| H2S | acido solfidrico | solfuro di diidrogeno |
Anche l'acido cianidrico, HCN, è da considerarsi un idracido pur essendo un composto ternario.
Con la nomenclatura IUPAC si aggiunge al non metallo il suffisso -uro con l'aggiunta del termine idrogeno.
Il nome tradizionale deriva dal nome dell'elemento, con desinenza -idrico, preceduto dal termine acido.
Composti binari con l'ossigeno
Gli ossidi sono composti binari che derivano dall'unione di un metallo o un non metallo con l'ossigeno.
La nomenclatura tradizionale li distingue rispettivamente in ossidi e anidridi, mentre per la IUPAC sono entrambi ossidi.
Ossidi
Gli ossidi, o ossidi basici, derivano dall'unione di un metallo con l'ossigeno:
![]()
![]()
Per scrivere correttamente l'ossido si mette prima il metallo e poi l'ossigeno.
Poiché il sodio ha valenza I e l'ossigeno II, per scrivere correttamente il composto abbiamo bisogno di due atomi di sodio:
![]()
In genere, per bilanciare basta mettere la valenza di un elemento come indice dell'altro e poi, eventualmente, semplificare.
A questo punto si riequilibra il numero di atomi a sinistra e a destra ponendo un numero a sinistra del composto
2Na + O2 → 2Na2O ossido di disodio
Il nome, secondo la nomenclatura IUPAC è:
(di, tri ...) ossido seguito dal nome del metallo, con eventuale prefisso in base al numero di atomi.
FeO = ossido di ferro
Fe2O3 = triossido di diferro
Con la nomenclatura tradizionale abbiamo invece:
ossido dell'elemento con l'aggiunta di una desinenza in base alla valenza:
- oso per quella più bassa
- ico per quella più alta
perciò nei due esempi sopra abbiamo rispettivamente:
ossido ferroso e ossido ferrico
Anidridi
Le anidridi, o ossidi acidi, derivano dall'unione di un non metallo con l'ossigeno:
![]()
![]()
anidride solforosa
Secondo la moderna nomenclatura anche questo è un ossido e segue le medesime regole.
Per il bilanciamento si procede come per gli ossidi (la reazione in alto non richiede bilanciamento).
Anche la denominazione IUPAC è la medesima (diossido di zolfo), mentre per quella tradizionale il composto si chiama anidride: anidride solforosa.
Come per gli ossidi, le anidridi abbiamo:
ipo ... oso
... oso
... ico
per ... ico
![]() = anidride ipoclorosa (ossido di dicloro)
= anidride ipoclorosa (ossido di dicloro)
![]() = anidride clorosa (triossido di dicloro)
= anidride clorosa (triossido di dicloro)
![]() = anidride clorica (pentossido di dicloro)
= anidride clorica (pentossido di dicloro)
![]() = anidride perclorica (eptossido di dicloro)
= anidride perclorica (eptossido di dicloro)
Se le valenze sono due si usano -oso e -ico.
Segnaliamo la nomenclatura tradizionale dell'azoto che ha 5 valenze:
| valenza | anidride | nome tradizionale |
|---|---|---|
| 1 | N2O | Protossido d'azoto |
| 2 | NO | Monossido di azoto |
| 3 | N2O3 | Anidride nitrosa |
| 4 | NO2 - N2O4 | Ipoazotide |
| 5 | N2O5 | Anidride nitrica |
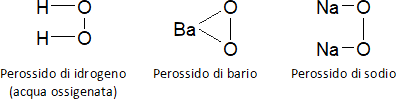
Perossidi
Si tratta di ossidi particolari con due atomi di ossigeno legati tra loro. Sono composti instabili perché tendo a perdere l'ossigeno che hanno in più.
I principali composti sono:
Composti ternari
Idrossidi
Sono composti ternari che derivano dall'unione di un ossido basico con l'acqua:
![]()
Na2O + H2O→ 2NaOH idrossido di sodio
Per scrivere correttamente l'idrossido si mette prima il metallo, seguito da tanti ossidrili (OH) quante sono le valenze del metallo.
Per la nomenclatura tradizionale e IUPAC valgono le regole indicate sopra, sostituendo idrossido al posto di ossido.
Acidi
Gli acidi (ossiacidi) sono composti ternari che derivano dall'unione di un ossido acido (anidride) con l'acqua:
![]()
SO2 + H2O → H2 SO3 acido solforoso
Per scrivere correttamente gli acidi ternari (H, non metallo, O) in genere basta fare la somma degli elementi che stanno a sinistra e mettere prima H, poi il non metallo e infine O.
Secondo la nomenclatura tradizionale (la più usata) si mette la parola acido seguita dal nome dell'anidride.
La IUPAC prevede il suffisso -ico per tutti, con l'ossigeno seguito da un prefisso.
Nel caso esemplificato abbiamo: acido triossosolforico.
Alcune anidridi possono combinarsi con l'acqua in rapporti diversi. In questo caso si adoperano i prefissi:
-meta quando si combina con 1H2O
-piro quando si combina con 2H2O
-orto quando si combina con 3H2O
P2O5 + H2O → 2HPO3 acido metafosforico
P2O5 + 3H2O → 2H3PO4 acido ortofosforico
Sali
Sono composti da un metallo con un non metallo (sali binari) ed eventualmente l'ossigeno (sali ternari).
Vediamo un esempio di formazione di sale.
![]()
NaOH + H2SO3→ Na2SO3 + H2O solfito di (di)sodio
Per scrivere il sale si mette prima il metallo dell'idrossido seguito da ciò che rimane dell'acido togliendo H. Lo stesso vale per gli idracidi: in questo caso abbiamo un sale binario (senza O).
Per bilanciare il sale e poi la reazione, valgono le stesse regole degli ossidi.
Per quanto riguarda la nomenclatura:
| acido | sale |
|---|---|
| - oso | - ito |
| - ico | - ato |
| - idrico | - uro |
I sali possono essere ottenuti anche in altri modi e non sempre è presente l'acqua.
| metallo + non metallo → sale | Fe + S → FeS |
| ossido + anidride → sale | MgO + CO2 → MgCO3 |
| ossido + acido → sale + acqua | CuO +H2SO4 → CuSO4 + H2O |
| idrossido + anidride → sale + acqua | Mg(OH)2+CO2→ MgCO3 + H2O |
| idrossido + acido → sale + acqua | NaOH + HCl → NaCl + H2O |
| metallo + acido → sale + idrogeno | Zn + 2HCl → ZnCl2 + H2 |
Sali acidi, basici e doppi
Quando abbiamo acidi poliprotici, cioè con più di un idrogeno, è possibile sostituire tutti gli idrogeni, come abbiamo fatto in precedenza, oppure lasciarne uno o più. In questo caso abbiamo i sali acidi:
NaOH + H2CO3 → Na2CO3 carbonato di disodio (sale neutro)
NaOH + H2CO3 → NaHCO3 carbonato acido di sodio - idrogenocarbonato di sodio - bicarbonato di sodio (sale acido)
Nella molecola si può anche avere un ossidrile derivante dall'idrossido, per cui abbiamo i sali basici:
AlOHSO4 solfato (mono)basico di alluminio
I sali doppi sono formati da ioni metallici diversi uniti allo stesso ione negativo. La dolomite, ad esempio, è un sale doppio di calcio e magnesio.
MgCa(CO3)2

