Reazioni complete e reversibili
Una reazione può avvenire in modo completo, quando i reagenti si trasformano completamente nei prodotti:
![]()
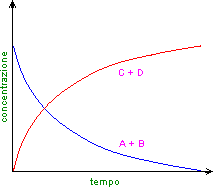
Ci sono tuttavia reazioni che non avvengono completamente, per cui quando in una reazione si forma una certa quantità di prodotto, parte di esso si ritrasforma nei reagenti finché non si raggiunge l'equilibrio: si tratta di una reazione reversibile.
![]()
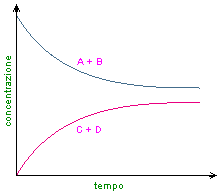

Condizioni di equilibrio
Quando si parla di equilibrio si pensa a qualcosa di statico, in cui la reazione è cessata; in realtà abbiamo un equilibrio dinamico, dove si formano tante molecole quante si decompongono.
Lo stato di equilibrio di una reazione incompleta corrisponde alle condizioni in cui la reazione diretta e la reazione inversa si svolgono con la stessa velocità.
Costante di equilibrio e la L.A.M.
La velocità di una reazione è direttamente proporzionale alla concentrazione dei reagenti perciò, considerando la reazione:
aA + bB ↔ cC + dD
per la reazione diretta: v1 = k1 [A]a [B]b
per la reazione inversa: v2 = k2 [C]c [D]d
poiché all'equilibrio: v1 = v2
k1 [A]a [B]b = k2 [C]c [D]d
da cui abbiamo:
![]()
perciò la seguente relazione esprime la costante di equilibrio:
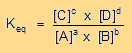
che costituisce la Legge dell'azione di massa (L.A.M.)
In un sistema all'equilibrio, il prodotto delle concentrazioni dei prodotti, fratto il prodotto della concentrazione dei reagenti, ciascuno elevato al proprio coefficiente stechiometrico, è costante a temperatura costante.
Quando la concentrazione è espressa in moli/litro al posto di Keq si mette Kc.
La costante di equilibrio si ricava determinando, con metodi chimico-fisici, le concentrazioni dei singoli componenti all'equilibrio, che vanno inserite nella relazione matematica.
Per ciascuna relazione il valore della costante di equilibrio dipende dalla temperatura, ma non dalle concentrazioni iniziali.
Se Keq > 1 la reazione è spostata verso i prodotti, perciò una gran parte dei reagenti si è trasformata in prodotti e il rendimento della reazione è superiore al 50%.
Se Keq < 1 la reazione è spostata verso i reagenti perciò la dissociazione è scarsa e il rendimento della reazione è basso.
Se Keq = 1 le concentrazioni dei prodotti e dei reagenti sono uguali o molto simili e il rendimento è di circa il 50%.
Principio di Le Châtelier
Quando una reazione è all'equilibrio, se si modificano le condizioni del sistema, la reazione si sposta nella direzione che permette di contrastare tale variazione.
Variazioni di concentrazione
Aggiungendo un reagente o asportando un prodotto formatosi da un sistema in equilibrio, l'equilibrio si sposta verso destra, cioè nella direzione che consente la scomparsa del reagente o la formazione di nuovo prodotto da aggiungere a quello mancante.
Variazione di volume
Per una reazione di equilibrio in fase gassosa che avviene senza variazioni del numero di moli tra reagenti e prodotti, una variazione del volume del recipiente non apporta alcuna variazione all'equilibrio.
H2 (g) + I2 (g) ↔ 2HI(g)
Quando però la reazione avviene con variazione del numero delle moli si ha uno spostamento dell'equilibrio.
N2 (g) + 3H2 (g) ↔ 2NH3 (g)
In questo caso, una diminuzione del volume comporta lo spostamento della reazione verso destra dove ci sono meno moli.
Variazione di pressione
Le variazione di pressione hanno influenza soltanto sugli equilibri delle reazioni in cui il numero complessivo di moli allo stato gassoso varia nel passaggio dai reagenti ai prodotti.
Se in un sistema all'equilibrio si aumenta la pressione, l'equilibrio si sposta verso la formazione delle sostanze che occupano minore volume, cioè dove diminuisce il numero delle moli, poiché la pressione è direttamente proporzionale al numero di moli.
Variazione di temperatura
Poiché la costante di equilibrio ha un valore specifico per ogni temperatura, al variare della temperatura varia anche la Kc. Infatti, sia la reazione diretta che quella inversa all'equilibrio sono accelerate da un aumento di temperatura, ma in modo differente, perciò il valore della costante di equilibrio viene modificato.
Per fare delle previsioni occorre conoscere il ΔH di reazione: se è positivo la reazione è endotermica e il calore può essere considerato un reagente, se è negativo è invece esotermica è il calore può essere considerato un prodotto.
Una reazione di equilibrio esotermica è favorita da un abbassamento della temperatura (sottrazione di calore). Una reazione di equilibrio endotermica è favorita da un innalzamento della temperatura (somministrazione di calore).
In genere, nelle reazioni endotermiche l'aumentare della temperatura induce un aumento della Kc, mentre nelle reazioni esotermiche provoca una diminuzione della Kc.
Aggiunta di un catalizzatore
L'aggiunta di un catalizzatore non ha alcun effetto sull'equilibrio; infatti, il catalizzatore, abbassando l'energia di attivazione, aumenta la velocità di reazione. Tale effetto, però, si manifesta contemporaneamente sia sulla reazione diretta che quella inversa e l'equilibrio non sarà spostato.
Keq in equilibri eterogenei
Quando i componenti del sistema sono nella stessa fase abbiamo equilibri omogenei. Se invece i componenti sono presenti in fasi differenti, costituiscono equilibri eterogenei.
Nei sistemi eterogenei in equilibrio, il valore della costante non dipende dalla quantità dei solidi o liquidi presenti, ma solo dalla concentrazione molare dei componenti in fase gassosa.
L'aggiunta, perciò di sostanze solide o liquide non modifica l'equilibrio.
Se consideriamo la reazione:
![]()
la costante di equilibrio ingloba anche il C solido.
![]()
Prodotto di solubilità
Ad una determinata temperatura, in una soluzione satura il prodotto delle concentrazioni degli ioni, elevato al proprio coefficiente stechiometrico, rimane costante. Il prodotto di solubilità rappresenta il valore massimo del prodotto delle concentrazioni ioniche che si possono avere in soluzione a quella temperatura.
Se mettiamo AgCl in acqua, essendo un sale poco solubile, rimane per gran parte indissociato e la soluzione è satura.
![]()
![]()
Poiché AgCl è un solido puro in equilibrio con gli ioni in soluzione, la sua concentrazione si può ritenere costante e inglobarla nella Keq. La nuova costante si chiama prodotto di solubilità (Kps).
Kps = [Ag+] [Cl-]
La solubilità è buona quando il prodotto di solubilità è elevato.
Se si vuole abbassare la concentrazione di Ag+ si può aggiungere un cloruro solubile come HCl. Per il principio di Le Châtelier, aumentando la concentrazione di Cl- l'equilibrio si sposta a sinistra: effetto dello ione comune.
Questo principio può essere applicato per abbattere la concentrazione di ioni metallici nocivi in acque inquinate, favorendo la deposizione di composti insolubili che si depositano nelle vasche di decantazione dove vengono recuperati.

