Raggio atomico
Pur non potendo individuare il limite netto dell'atomo, dal momento che gli elettroni sono definiti da funzioni d'onda, possiamo immaginare che complessivamente formino una sfera, di cui siamo in grado di determinarne il raggio.
Il raggio atomico è la distanza media tra il nucleo e gli elettroni del livello più esterno.
Il raggio cresce lungo il gruppo perché gli elettroni si collocano progressivamente su livelli sempre più lontani dal nucleo e gli fanno da schermo.
Lungo il periodo il raggio diminuisce perché gli elettroni, ponendosi nello stesso livello energetico, non fanno da schermo all'aumento progressivo della carica nucleare.

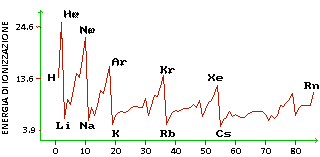
Energia di ionizzazione
Si definisce energia di ionizzazione l'energia necessaria per allontanare un elettrone da un atomo, facendolo diventare uno ione positivo.
ATOMO + A.E. → IONE+ + 1e-
Scendendo lungo i gruppi l'energia di ionizzazione diminuisce perché gli elettroni sono più lontani dal nucleo e quindi risentono meno della loro attrazione, avendo anche lo schermo degli elettroni nei livelli precedenti.
L'energia di ionizzazione cresce, invece, lungo il periodo da sinistra a destra, perché aumenta il numero atomico e quindi la carica del nucleo.
Affinità elettronica
L'affinità elettronica è l'energia che viene liberata quando un atomo acquista un elettrone diventando uno ione negativo.
ATOMO + 1e- → IONE- + A.E.
Il comportamento dell'affinità elettronica è lo stesso del potenziale di ionizzazione, poiché è influenzata dai medesimi fattori.
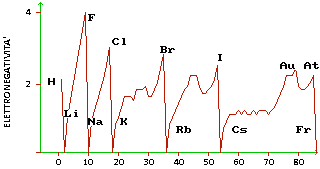
Elettronegatività
L'elettronegatività è la tendenza che un atomo ha di attrarre a sé gli elettroni di un altro atomo in un legame.
Essendo in relazione con le due grandezze precedenti, l'elettronegatività varia nello stesso modo: gli elementi sulla destra della tavola periodica hanno l'elettronegatività più alta tranne i gas nobili, il cui valore è 0.