Sono stati proposti i seguenti meccanismi per spiegare come il soluto si sciolga nel solvente:
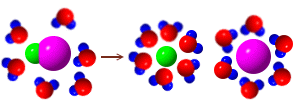
- Dissociazione. È il processo che riguarda i composti ionici, i quali si sciolgono perché intervengono forze elettriche (legami ioni-dipolo) tra un solvente polare, che attira gli ioni del composto, e il composto che vede indebolirsi i legami ionici (la parte negativa del solvente attira gli ioni positivi e viceversa). In questo modo gli ioni sono progressivamente idratati e quindi allontanati nella soluzione secondo il processo chiamato solvatazione (nel caso dell'acqua si parla di idratazione), provocando la dissociazione del composto.
Es. H2O e NaCl
Il processo non avviene in direzione opposta perché l'acqua, circondando gli ioni, funziona da schermo per le cariche e ne impedisce il contatto.

- Ionizzazione. Riguarda composti molecolari che posti in un solvente polare formano ioni che non erano presenti nel composto. Infatti, il solvente polarizza ulteriormente il legame covalente fino a farlo diventare ionico.
Es. H2O e HCl che si ionizza in H+ e Cl-.
- Solubilizzazione. Il solvente polare rompe i legami deboli tra le molecole, disperdendole nella soluzione senza formare ioni.
Es. H2O e glucosio.
In questo caso, tra le molecole di glucosio ci sono legami idrogeno, ma anche l'acqua può formarli, pertanto le molecole superficiali di glucosio si staccano per formare nuovi legami con l'acqua.

- Solubilizzazione di composti non polari. Grassi e benzina, essendo formati entrambi da molecole non polari, si mescolano non perché si instaura una particolare relazione tra soluto e solvente, ma perché non ci sono forze repulsive tra i due tipi di molecole che sono in continuo e disordinato movimento.
Es. olio e benzina.
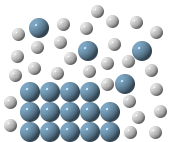
Velocità di solubilizzazione
A parità di temperatura e quantità di soluto, la velocità di solubilizzazione dipende da diversi fattori:
- suddivisione dei cristalli: un composto suddiviso, avendo una maggiore superficie esposta, è più facilmente idratabile;
- agitazione: mescolare il soluto lo porta più rapidamente a contatto con le particelle di solvente;
- La velocità di solubilizzazione dipende anche dall'energia cinetica delle particelle perciò è direttamente proporzionale alla temperatura. In questo caso, aumentano gli urti in grado di spezzare i legami del soluto.

