Massa atomica e molecolare
L'atomo è una particella molto piccola e non può essere direttamente pesata, per questo la sua massa si calcola in rapporto a quella di un altro atomo preso come riferimento.
In passato è stato preso come riferimento l'atomo più piccolo, quello dell'idrogeno; si è poi passati alla sedicesima parte dell'atomo di ossigeno, mentre dal 1961 è stato definitivamente fissato come riferimento la dodicesima parte della massa del carbonio-12.
Quando si scelse l'idrogeno, si denominò come unità di misura uma, unità di massa atomica. Oggi l'unità di misura è il dalton e indicata con u, e non il grammo.

In chimica spesso si usano in modo indistinto i termini peso e massa, con il significato fisico di massa; anche se ciò non è propriamente corretto, in questa sede, abbiamo preferito utilizzare il peso invece della massa.
Il peso atomico (PA) - o massa atomica relativa - di un elemento è la massa dei suoi atomi, espressa in dalton, degli atomi di quell'elemento.
È espressa in dalton poiché è il rapporto tra la massa dell'elemento e l'unità di massa atomica, perciò relativa.
Il peso atomico si trova indicato nella tavola periodica. Ad esempio, il PA dell'idrogeno è 1.008 u.
Nel caso dei composti si usa il peso molecolare (PM) o massa molecolare relativa, che deriva dalla somma dei pesi atomici.
Il peso molecolare di H2O è:
![]()
perciò
![]()
Numero di Avogadro
In laboratorio non è possibile lavorare con misure così piccole:
1 u = 1,66 · 10-24 g
1 g = 6,023 · 1023 u
per questo è stato introdotto un numero particolare, il numero di Avogadro (N), che permette di passare da dalton a grammi, collegando così il mondo microscopico con quello macroscopico.
![]()
Se, ad esempio, un atomo di carbonio pesa 12 u, 6,023·1023 atomi di carbonio pesano 12 g.
La mole
La mole è una quantità di sostanza (atomi o molecole), pari al peso atomico (o molecolare), costituita da un numero di Avogadro di atomi o molecole.

m = massa del campione espressa in grammi
M = massa molare: PA o PM espressa in g/mol.
La mole si indica con n e l'unità di misura è mol.
Una mole di carbonio corrisponde a 12 g e contiene 6,023·1023 atomi.
Una mole di idrogeno corrisponde a 1 g e contiene 6,023·1023 atomi.
Massa molare
La massa molare (M), cioè la massa di una mole, è uguale alla massa atomica (o molecolare) relativa espressa in grammi.
L'unità di misura della massa molare è g/mol.
Massa atomica e massa molare hanno lo stesso valore numerico ma diversa unità di misura, ad esempio, un atomo di carbonio pesa 12 u, perciò la massa molare è 12 g/mol.
Determinazione della composizione percentuale
Per determinare la composizione percentuale di un composto si procede nei seguenti due modi, secondo i dati a disposizione.
1
Abbiamo a disposizione la massa dei singoli elementi.
Supponiamo che la decomposizione di un composto abbia dato il seguente risultato:
9.14 g silicio Si
30.0 g sodio Na
20.86 g ossigeno O
La massa totale del composto, essendo rispettata la legge di Lavoisier è:
9.14 g + 30.0 g + 20.86 g = 60 g
Le percentuali perciò sono:

2
Conosciamo la formula del composto.
Vogliamo determinare la percentuale degli elementi di CaSO4.
Nella tavola periodica troviamo i PA degli elementi:
PACa = 40 g/mol
PAS = 32 g/mol
PAO = 16 g/mol
![]() = 40 + 32 + 16•4 = 136 g/mol
= 40 + 32 + 16•4 = 136 g/mol
Possiamo ora determinare le percentuali (le unità di misura si semplificano).
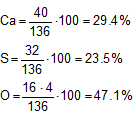
Determinazione della formula minima
Anche qui per determinare la formula abbiamo due possibilità in base ai dati. Troviamo la formula minima perché per arrivare alla formula molecolare serve conoscere anche il peso molecolare calcolato sperimentalmente.
1
Abbiamo a disposizione la massa dei singoli elementi.
Supponiamo che la decomposizione di un composto abbia dato il seguente risultato:
46.3 g mercurio Hg
3.7 g ossigeno O
La massa totale del composto, essendo rispettata la legge di Lavoisier è:
PM = 46.3 g + 3.7 g = 50 g
Nella tavola periodica troviamo i PA degli elementi:
PAHg = 200.5 g/mol
PAO = 16 g/mol
Troviamo ora le moli.

Dividendo tutto per 0.23 otteniamo un rapporto di 1 : 1, perciò la formula minima è HgO.
2
Conosciamo la percentuale degli elementi.
C = 40.02%
H = 6.66%
O = 53.32%
Nella tavola periodica troviamo i PA degli elementi:
PAC = 12 g/mol
PAH = 1 g/mol
PAO = 16 g/mol
La percentuale mi indica quanti grammi dell'elemento sono presenti in 100 g di composto. Posso ora trovare le moli.
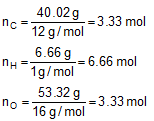
Dividendo per 3.33 si ottiene un rapporto 1 : 2 : 1, cioè gli indici numerici da scrivere in basso a destra dell'elemento.
La formula minima è CH2O.
Determinazione della formula molecolare
Se conosciamo per via sperimentale il peso molecolare, possiamo arrivare alla formula molecolare.
Partendo dall'ultimo esempio, sperimentalmente è stato determinato che il PM = 180 g/mol.
Calcoliamo il peso molecolare a partire dalla formula minima CH2O:
![]()
Dividendo il PM sperimentale con quello teorico, otteniamo il fattore di moltiplicazione:
![]()
La formula molecolare è C6H12O6.

