Gli atomi che presentano elettronegatività uguale o simile condividono uno o più elettroni per formare un legame covalente.
Quando gli atomi sono uguali si forma il legame covalente puro.
![]()
Questo legame può essere semplice, doppio o triplo in base a quanti elettroni sono condivisi tra i due atomi:
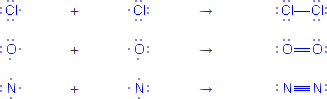
Quando gli atomi sono diversi, ma l'elettronegatività è inferiore a 1.9, si forma un legame covalente polare perché gli elettroni vengono spostati verso l'elemento più elettronegativo.
![]()
Gli elettroni non sono equamente condivisi tra i due atomi, ma sono spostati verso l'elemento più elettronegativo che assumerà una carica parzialmente negativa (δ-), mentre l'altro sarà parzialmente positivo (δ+).
![]()
Anche in questo caso possiamo avere legami semplici, doppi o tripli.
I legami polari possono rendere le molecole polari (dipoli),
![]()
a meno che gli atomi non siano disposti in modo simmetrico.
![]()
Durante il legame covalente si possono sovrapporre due orbitali di tipo s, un orbitale s con un orbitale p oppure due orbitali p posti lungo la stessa direzione: in questo caso si parla di legame σ, un legame molto forte. Con gli orbitali p si possono avere anche sovrapposizioni con gli assi posti parallelamente (quando i legami sono doppi o tripli) e si formano, oltre al legame σ di cui si è detto sopra, uno o due legami π, più deboli rispetto al precedente.
![]()
legame σ

non si forma
![]()
legame σ
![]()
legame σ
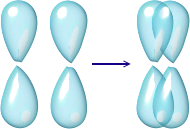
legame π

