Tra le numerose ed importanti funzioni delle proteine abbiamo quella enzimatica. Gli enzimi sono proteine globulari con funzione di catalizzatori biologici che, abbassando l'energia di attivazione, ne accelerano le reazioni.
Negli organismi viventi avvengono moltissime reazioni, gran parte delle quali è ad alta energia di attivazione, cioè si svolgono con difficoltà e troppo lentamente perché si verificano a temperature piuttosto basse, generalmente tra i 20 e i 40 °C. Per questo gli essere viventi possiedono un elevatissimo numero di enzimi.

Gli enzimi, come abbiamo visto per i catalizzatori inorganici,
- abbassano l'energia di attivazione,
- modificano la velocità di reazione,
- rimangono inalterati dopo la reazione,
ma, diversamente da quelli inorganici,
- sono altamente specifici per ogni reazione.
L'alta specificità dipende dal fatto che un enzima possiede una specie di cavità, il sito attivo, nel quale si inserisce il substrato che deve reagire, secondo un modello chiave-serratura.
Il substrato (S) si inserisce nel sito attivo dell'enzima (E) al quale si lega temporaneamente con legami deboli per formare il complesso intermedio E-S. Avviene la reazione con formazione dei prodotti (P) e l'enzima è libero di catalizzare una nuova reazione.
![]()

Secondo studi più recenti, quando il substrato viene in contatto con l'enzima, il sito attivo si modifica per adattarsi meglio alla molecola e facilitare la reazione (modello dell'adattamento indotto).

La specificità riguarda anche gli isomeri, infatti, solo uno di essi può inserirsi nel sito attivo dell'enzima.

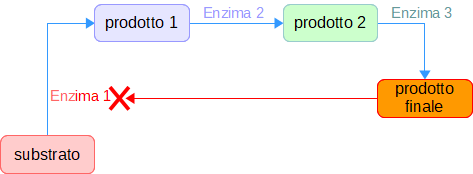
Nella cellula le reazioni avvengono spesso in sequenze costituite da 2 a oltre 20 reazioni concatenate, le vie metaboliche, lineari o cicliche, con una serie di enzimi dopo il prodotto di una reazione è il substrato di quella successiva. La mancanza di un solo enzima della sequenza ne impedisce il completamento, e ciò può provocare danni all'organismo.
![]()
Il nome degli enzimi è a volte di fantasia ma, più correttamente deriva da quello del substrato o del tipo di reazione seguito dal suffisso -asi.
| Nome | Funzione |
|---|---|
| Ossidoreduttasi | Catalizzano le reazioni di ossidoriduzione. |
| Tra(n)sferasi | Catalizzano il trasferimento di gruppi funzionali da una molecola a un'altra. |
| Idrolasi | Catalizzano l'idrolisi di carboidrati, esteri, proteine utilizzando l'acqua. |
| Liasi | Catalizzano l'addizione di gruppi atomici ai doppi legami e viceversa senza consumo di energia. |
| Isomerasi | Catalizzano le reazioni di trasformazione di un isomero in un altro. |
| Ligasi | Catalizzano la formazione di legami covalenti e consumano di energia. |
Cofattori e coenzimi
Alcuni enzimi, per svolgere la propria funzione, a volte hanno bisogno di cofattori, ioni inorganici come il ferro, il calcio, il rame, lo zinco, il manganese, il cobalto, il magnesio.
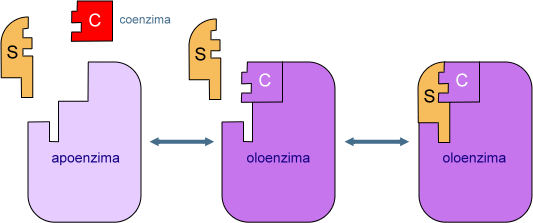
In alcuni casi, invece, necessitano di coenzimi, che sono piccole molecole organiche non proteiche (gruppi prostetici) oppure vitamine idrosolubili, componenti indispensabili della nostra dieta.
![]()

Regolazione dell'attività enzimatica
Gli organismi non producono tutti gli enzimi contemporaneamente, alla massima velocità e in grande quantità, ma solo in base alle necessità, evitando sprechi e accumuli di sostanze indesiderate, attraverso una fine regolazione o inibizione.
La regolazione avviene con diversi meccanismi.
Regolazione a livello di substrato: più alta è la concentrazione del substrato, più veloce è la reazione fino alla saturazione, quando non ci sono più enzimi disponibili.

Regolazione allosterica. Gli enzimi allosterici hanno due siti distinti: il sito attivo e il sito regolatore di attivazione o inibizione. Nel sito regolatore si inseriscono molecole che modificano leggermente la struttura dell'enzima, aumentando (attivatori) o diminuendo (inibitori) l'attività nei confronti del substrato.
La regolazione allosterica adatta la velocità delle reazioni enzimatiche alle condizioni locali e gli enzimi si attivano solo quando il substrato raggiunge elevate concentrazioni poiché hanno bassa affinità per esso.

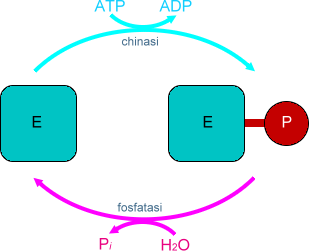
Regolazione per modificazione covalente. La modificazione covalente consiste nel legare covalentemente o separare gruppi atomici alle catene laterali di alcuni amminoacidi. La risposta è meno immediata e meno breve di quella allosterica e adatta la velocità delle reazioni alle condizioni generali. Un esempio è la fosforilazione/defosforilazione di un enzima medianti gli enzimi specifici rispettivamente chinasi e fosfatasi.
Alterazione di pH o temperatura. Gli enzimi lavorano in un ristretto range di condizioni ambientali: una modifica di temperatura o pH altera la struttura tridimensionale della molecola e quindi la sua funzionalità. Nell'uomo i valori ottimali sono pH 7,4 e temperatura 37 °C.

Attivazione degli enzimi inattivi: un enzima è prodotto in forma inattiva ed è attivato solo quando serve.
Inibizione enzimatica. Molti enzimi si legano reversibilmente o irreversibilmente a molecole, inibitori, che riducono o bloccano l'attività enzimatica. Ci sono diversi meccanismi di inibizione:
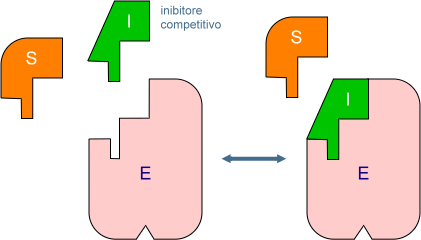
- Inibizione competitiva: una molecola simile al substrato si inserisce nel sito attivo impedendo l'accesso di quest'ultimo perciò non si verifica alcuna reazione. Questo dipende dalla concentrazione relativa delle due molecole: la più abbondante si inserisce nel sito attivo.
- Inibizione reversibile non competitiva: una molecola di inibitore si inserisce nel sito allosterico, diverso dal sito attivo, modificando temporaneamente la forma del sito attivo, che non è più in grado di legare efficacemente il substrato e di far avvenire la reazione. Si veda l'immagine della regolazione allosterica.
- Inibizione retroattiva (feedback negativo). Quando il prodotto finale di una reazione in una via metabolica supera una certa concentrazione, le sue molecole cominciano a inibire in modo non competitivo l'attività del primo enzima, riducendo o bloccando la via metabolica.