La cella elettrolitica
L'energia elettrica può essere impiegata per far avvenire le ossidoriduzioni non spontanee.
Facendo passare la corrente continua attraverso una soluzione ionica si ha la trasformazione dell'energia elettrica in energia chimica, con un processo chiamato elettrolisi.
Una cella elettrolitica è costituita da un recipiente con 2 elettrodi immersi in una soluzione che contiene ioni per poter condurre la corrente.
I liquidi che contengono ioni (elettroliti) possono essere acidi, basi, sali, solidi ionici fusi, ma non solidi molecolari (es. zucchero). In particolare, i cationi (+) si spostano al catodo e gli anioni (-) all'anodo.
Elettrolisi di un sale fuso
In un contenitore resistente alle alte temperature si pone del sale fuso, ad esempio NaCl. In esso si immergono 2 elettrodi inerti di grafite collegati ad un generatore di corrente elettrica.
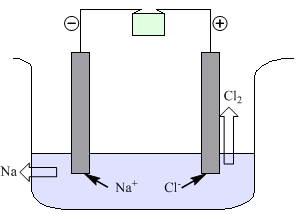
Il polo negativo (catodo) attira i cationi Na+ e si ha una riduzione:
Il sodio metallico prodotto si deposita sul fondo del recipiente.
Il polo positivo (anodo) attira gli anioni Cl- e avviene una ossidazione:
Il cloro gassoso che si produce esce dal recipiente.
Nella cella elettrolitica, rispetto a quella elettrochimica, i segni di anodo e catodo sono invertiti, ma all'anodo si ha sempre una ossidazione e al catodo una riduzione.
Quando abbiamo contemporaneamente più specie chimiche:
al catodo ![]() si scaricano per primi (riduzione) i cationi con potenziale di riduzione maggiore;
si scaricano per primi (riduzione) i cationi con potenziale di riduzione maggiore;
all'anodo ![]() si scaricano per primi (ossidazione) gli anioni con potenziale di riduzione minore.
si scaricano per primi (ossidazione) gli anioni con potenziale di riduzione minore.
Elettrolisi di soluzioni saline
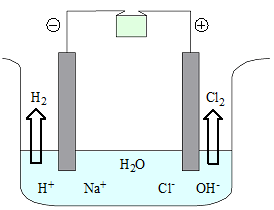
In un recipiente, contenete una soluzione concentrata di NaCl, si immergono 2 elettrodi di grafite collegati ad un generatore di corrente.
In questo caso sono presenti 3 specie che possono ridursi al catodo:
| Na+ + 1e- → Na 2H2O + 2e- → 2OH- + H2 2H+ + 2e- → H2 | E0 = -2,71V E0 = -0,83V E0 = 0,00V |
È favorita la riduzione dell'idrogeno perché ha un potenziale di riduzione più positivo ma, vista la piccola quantità, si riduce l'acqua con produzione di H2 gassoso e ioni OH-. Na+, pur essendo in elevata concentrazione, ha un potenziale di riduzione troppo basso.
Anche all'anodo sono presenti 3 specie che possono ossidarsi all'anodo (le reazioni sono scritte nel verso opposto rispetto alla tavola dei potenziali standard):
| 4OH- - 4e- → 2H2O + O2 2H2O - 4e-→ 4H+ + O2 2Cl- - 2e- → Cl2 | E0 = +0,40V E0 = +1,23V E0 = +1,36V |
Dovrebbe ossidarsi l'OH-, che ha il potenziale di riduzione minore, invece, sperimentalmente, si osserva l'ossidazione di Cl-, pur avendo E0 leggermente superiore all'acqua, perché:
- il Cl- si sposta più rapidamente;
- la concentrazione è elevata:
- l'ossigeno ha una sovratensione (energia in più da fornire) che ne impedisce la formazione.
Riassumendo:

La soluzione assume un carattere basico.
Questa reazione può essere sfruttata industrialmente per ottenere H2 e Cl2 gassosi, NaOH, HCl, NaClO.
Elettrolisi di soluzioni acide
Nelle soluzioni acide è sempre presente una grande quantità di ioni H+, perciò al catodo si forma sempre H2 gassoso secondo la reazione:
2H+ + 2e- → H2
Ciò che avviene al catodo dipende dal tipo di acido.
Elettrolisi di soluzioni basiche
Nelle soluzioni basiche l'abbondanza di ioni OH- porta sempre alla formazione di O2 all'anodo:
4OH- - 4e- → 2H2O + O2
mentre al catodo la reazione dipende dal tipo di base.
Elettrolisi dell'acqua

L'elettrolisi di H2O pura non è possibile perché è troppo poco dissociata, perciò si aggiunge una piccola quantità di HCl (o altro elettrolita) per renderla conduttrice.
Al catodo migrano: H+ e H2O;
all'anodo migrano: H2O, Cl- e OH-.
Poiché la concentrazione di H+, OH- e Cl- è trascurabile, solo l'acqua partecipa alla reazione:

Poiché 4H++ 4OH- → 4H2O
la reazione finale è:
cioè si ha la scomposizione dell'acqua in idrogeno ed ossigeno gassosi, dove l'idrogeno ha un volume doppio rispetto all'ossigeno.
Applicazioni dell'elettrolisi
Galvanostegia
La galvanostegia consiste nel ricoprire oggetti metallici con uno strato molto sottile di un altro metallo fatto depositare elettroliticamente, allo scopo di proteggere l'oggetto dalla corrosione oppure di renderlo più pregiato. Ad esempio, si può fare la doratura, l'argentatura, la cromatura, la stagnatura (il ferro stagnato è la latta), la zincatura, usando l'oggetto da ricoprire come catodo, l'anodo del corrispondente metallo e soluzioni elettrolitiche del rispettivo sale.
Se l'oggetto non è metallico lo si rende tale ricoprendolo con un'apposita vernice.
Elettroforesi
L'elettroforesi è un processo utilizzato per analizzare e separare macromolecole come proteine, acidi nucleici, ecc. infatti, alcune macromolecole dotate di carica elettrica poste in un gel di amido e sotto l'influenza di un campo elettrico generato da due elettrodi immersi nella soluzione (o gel) si spostano con velocità diversa, ottenendo la loro separazione.

