Il C, elemento del quarto gruppo e del secondo periodo, possiede 6 protoni e 6 elettroni disposti negli orbitali nel seguente modo:

ha cioè 2 elettroni spaiati nel livello più esterno. Poiché nei composti organici il C forma 4 legami covalenti, significa che un elettrone dell'orbitale 2s è promosso nell'orbitale 2p e poi si verifica l'ibridazione.
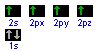
Ibridazione sp3
Si ottiene dal rimescolamento dell'orbitale s con 3 orbitali p.


I 4 orbitali ibridi si dispongono ai vertici di un tetraedro, con angoli di 109.5°.
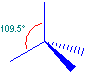

I legami che formano con gli altri elementi sono di tipo σ, perciò molto forti.
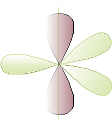
Ibridazione sp2
Dopo la promozione dell'elettrone, un orbitale s si ibrida con 2 orbitali p.


I 3 orbitali ibridi si dispongono sullo stesso piano con angoli di 120°, mentre l'orbitale p non ibridato si pone perpendicolarmente agli altri 3.

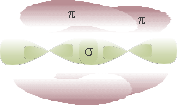
Quando si sovrappone un orbitale p non ibridato di un C con quello di un altro C si ha un legame π, più debole del legame σ; quindi, tra due atomi di C si ha un doppio legame: uno σ e uno π.
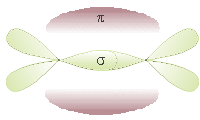
Ibridazione sp
Si ha quando un orbitale s si sovrappone ad un solo orbitale p.


I 2 orbitali ibridi ottenuti si dispongono lungo un asse con un angolo di 180°. Gli orbitali p non ibridati si pongono perpendicolari tra loro e agli orbitali ibridi.


Gli orbitali ibridi formano due legami σ con altri elementi, mentre tra i due C si ha un triplo legame: uno σ e due π.