Il numero di ossidazione
Il numero di ossidazione è la carica apparente che un elemento mostra in un composto, in confronto agli altri atomi con cui è legato.
Previsione dei numeri di ossidazione
Tenendo in considerazione le regole sotto elencate, è possibile prevedere il numero di ossidazione (n.o.) in un composto. Il numero si scrive in alto, sopra il simbolo:
![]()
- Una sostanza elementare ha sempre n.o. 0
- Uno ione ha n.o. corrispondente alla sua carica
- Una molecola ha complessivamente n.o. 0
- L'idrogeno ha generalmente n.o. +1
- L'ossigeno ha in genere n.o. -2
- Gli elementi del primo gruppo hanno n.o. +1
- Gli elementi del secondo gruppo hanno n.o. +2
Se, ad esempio, vogliamo conoscere il n.o. degli elementi di H2SO4, dobbiamo procedere nella seguente maniera:
- Complessivamente la molecola ha n.o. 0;
 (il numero scritto sotto è un artificio per indicare il valore totale del n.o. dell'idrogeno, considerando la presenza di due atomi);
(il numero scritto sotto è un artificio per indicare il valore totale del n.o. dell'idrogeno, considerando la presenza di due atomi);
- Con la semplice operazione matematica:
 si stabilisce il valore di X, cioè di S, che ha n.o. +4; quindi abbiamo:
si stabilisce il valore di X, cioè di S, che ha n.o. +4; quindi abbiamo:
![]()
Reazioni di ossidoriduzione (redox)
Una ossidoriduzione è una reazione di trasferimento apparente di elettroni da un elemento ad un altro. Il numero degli elettroni ceduti deve essere sempre uguale a quello degli elettroni acquistati.
L'ossidazione è data dalla perdita di elettroni, per cui il n.o. aumenta; nella reazione il composto che perde elettroni è l'agente riducente.
![]()
La riduzione comporta l'acquisto di elettroni, con diminuzione del n.o.; il composto che si riduce è l'agente ossidante.
![]()
Vediamo una reazione completa:
Scriviamo i numeri di ossidazione di ciascun elemento:

Individuiamo le coppie di elementi che si sono ossidati e ridotti:

Il carbonio si è ossidato perdendo 2 elettroni, mentre l'idrogeno si è ridotto acquistando un elettrone per ogni atomo:


Spontaneità delle ossidoriduzioni
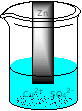 Immergiamo una lamina di zinco in una soluzione di CuSO4. La reazione teorica è:
Immergiamo una lamina di zinco in una soluzione di CuSO4. La reazione teorica è:
Zn + CuSO4 → Cu + ZnSO4
Osservando dopo un po' di tempo ciò che è accaduto nel recipiente, notiamo che si è depositato uno strato di rame metallico sulla lamina, mentre questa si è leggermente consumata. Contemporaneamente c'è un leggero aumento della temperatura.
Assegnando i numeri di ossidazione alla reazione in alto possiamo comprendere ciò che è avvenuto dal punto di vista chimico.
Zn si ossida perdendo 2 elettroni e diventando uno ione incolore che passa in soluzione:
ossidazione
Lo ione rame acquista i 2 elettroni ceduti dallo zinco, depositandosi come rame metallico:
riduzione
La reazione complessiva è:
 Immergiamo ora una lamina di rame in una soluzione di ZnSO4. La reazione teorica è:
Immergiamo ora una lamina di rame in una soluzione di ZnSO4. La reazione teorica è:
Cu + ZnSO4 → Zn + CuSO4
L'osservazione sperimentale, invece, ci mostra che non è successo nulla: il rame non è passato in soluzione e lo zinco non si è depositato sulla lamina.
Da queste due esperienze possiamo concludere che il rame ha una maggiore capacità di acquistare ioni rispetto allo zinco, perciò non esiste una specie ossidante o riducente in assoluto, ma una specie è più o meno ossidante (o riducente) di un'altra e non tutte le ossidoriduzioni sono spontanee.

