La termologia è un'antica disciplina che si occupa dei problemi connessi con la misura della temperatura e della misura e propagazione del calore.
Temperatura
La temperatura ci indica uno stato termico della materia, cioè fornisce una misura dell'intensità di calore da essa posseduto.
Questo concetto non va confuso con quello di calore, che vedremo nel prossimo paragrafo. Consideriamo per esempio un fiammifero acceso e un falò: entrambi possono essere alla stessa temperatura, ma il falò possiede una quantità di calore molto più alta perché dipende dalla quantità di materia. Inoltre, una stessa quantità di calore innalzerà molto di più la temperatura di una piccola quantità di acqua che non quella di una grande quantità (si veda l'esempio sulla capacità termica).

Poiché dipende dall'intensità della vibrazione dei suoi atomi o molecole (agitazione termica), la temperatura di un corpo è la misura dell'energia cinetica media delle particelle. Quanto più è elevata l'agitazione termica, tanto più è alta la temperatura.
Quando due corpi a diversa temperatura si trovano a contatto tra loro, la temperatura determina in quale direzione avviene il passaggio di calore.
Per misurare la temperatura occorre un'unità di misura.
Prendendo una miscela di ghiaccio fondente e acqua distillata alla pressione di un'atmosfera, si pone come riferimento il valore 0 al ghiaccio fondente (punto fisso) e 100 all'acqua in ebollizione a livello del mare (punto fisso) e poi si divide l'intervallo in 100 parti uguali. Si ottiene così la scala centigrada o Celsius (fisico svedese Anders Celsius 1701-1744).

Nei paesi anglosassoni le temperature di riferimento sono rispettivamente 32 e 212 e l'intervallo è suddiviso in 180 parti: scala Fahrenheit (fisico tedesco Daniel Gabriel Fahrenheit 1686-1736).
Esiste anche la scala Réaumur (fisico francese René-Antoine Ferchault de Réaumur 1683-1757), che però è inutilizzata, i cui punti fissi sono 0 e 80.
In fisica si usa una scala centigrada in cui lo 0 coincide con lo 0 assoluto, pari a circa -273,15 gradi centigradi (scala Kelvin proposta dal fisico britannico sir William Thomson, lord Kelvin 1824-1907) e corrisponde al valore limite al di sotto del quale non si può scendere. Allo zero assoluto le particelle sono ferme.
Per misurare la temperatura si usa il termometro che sfrutta la dilatazione termica, principio che vedremo più avanti.
![]()
Nel SI l'unità di misura della temperatura T, che è una grandezza fondamentale, è il grado Kelvin (K).
Per passare da una scala all'altra si usano le seguenti equazioni:
T = t + 273,15 = 5/9(tf - 32) + 273,15
t = T -273,15 = (tf - 32) ∙ 5/9
tf = 32 + 1,8t = 32 + 1,8(T -273,15)
Calore
Il calore è una particolare forma di energia che viene scambiata tra corpi a diversa temperatura.
Per lo scambio non è sempre necessario un contatto tra due corpi. Il calore ricevuto da un corpo può derivare dal trasferimento di un'altra forma di energia senza che vi sia un raffreddamento di un altro corpo. Per esempio, il rapido sfregamento delle mani porta al loro riscaldamento per la forza d'attrito senza che un altro corpo si raffreddi.
Il calore non è una forma di energia a sé stante ma proviene e si produce dalla trasformazione diretta o indiretta delle seguenti cinque forme di energia: meccanica, elettrica, chimica, radiante, nucleare.

Il calore dipende non solo dall'agitazione termica delle particelle del corpo ma anche dal numero delle particelle che lo compone. Lo vedremo nel paragrafo successivo.
La quantità di calore unitaria è quella necessaria per aumentare di 1 °C un grammo di acqua distillate e precisamente da 14,5 °C a 15,5 °C, alla pressione di 1 atm al livello medio del mare.
L'unità di misura della quantità di calore - definita utilizzando la variazione di temperatura alle condizioni dette sopra - si chiama caloria (cal), che non appartiene al SI, che invece usa il joule (J), poiché il calore è una forma di energia.
1 cal ≈ 4,1868 J
1 J ≈ 0,239006 cal
Per misurare la quantità di calore si usa il calorimetro. Il più comune è il calorimetro ad acqua, costituito da un contenitore di materiale isolante, all'interno del quale si pone un recipiente con una definita quantità d'acqua, un termometro e un agitare. Se nel recipiente si immerge un corpo più caldo o più freddo, il termometro registra la variazione di temperatura.

Calore specifico e capacità termica
Calore specifico
Il calore specifico di una sostanza è la quantità di calore necessaria per elevare di 1 °C la temperatura dell'unità di massa (1 kg) di tale sostanza.
La formula per il calcolo del calore specifico è in fondo al paragrafo.
L'acqua ha un elevato calore specifico (1 tra 14,5 °C e 15,5 °C), mentre i metalli hanno un basso calore specifico.
Se prendiamo due beker, uno con 200 ml di olio e l'altro con 200 ml di acqua e li riscaldiamo per lo stesso tempo (uguale quantità di calore fornito), il primo raggiunge una temperatura superiore rispetto al secondo perché ha un minore calore specifico: 2094 J/kg°C contro 4187 J/kg°C. Poiché l'acqua ha un elevato calore specifico, è necessario fornire una maggiore quantità di calore per unità di massa per innalzare la temperatura di 1 °C rispetto all'olio.

L'unità di misura è la stessa indicata nel paragrafo precedente.
Capacità termica
La capacità termica di un corpo è la quantità di calore necessaria per elevare la sua temperatura di 1 °C.
Quantitativamente è data dal prodotto della massa per il calore specifico:
C = m c
Ne consegue che l'acqua contenuta in una botte ha una capacità termica maggiore di quella contenuta in un bicchiere. Per portare quindi alla medesima temperatura l'acqua dei due contenitori è necessario fornire una maggior quantità di calore nel primo rispetto al secondo.
Nella figura abbiamo due becker contenenti rispettivamente 100 ml e 200 ml di acqua e hanno entrambi la stessa temperatura. Se riscaldiamo li per il medesimo tempo, il becker con la quantità minore di liquido raggiunge una temperatura doppia rispetto al secondo. A una quantità di liquido doppia corrisponde un aumento di temperatura doppio, a parità di calore fornito.
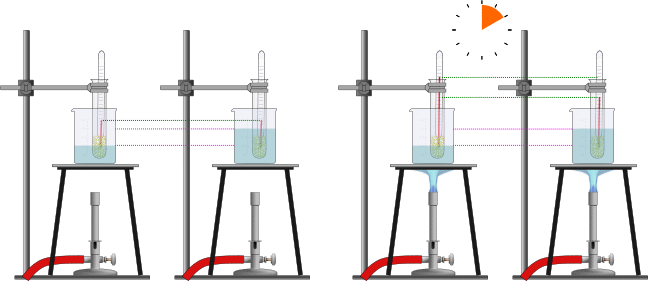
Questo esperimento dimostra che la temperatura è in stretto rapporto con il calore posseduto da un corpo, ma non si identifica con esso: a parità di calore fornito, la temperatura finale non è la stessa. Subito sotto l'aspetto quantitativo.
Relazione fondamentale della calorimetria
Abbiamo visto negli esempi precedenti che se si fornisce calore a un corpo la sua temperatura aumenta (o diminuisce se si sottrae calore). C'è perciò un rapporto tra la variazione della temperatura e la quantità di calore.
La relazione fondamentale della calorimetria è la seguente:
Q = m c Δt
Q = quantità di calore fornita a un corpo o ceduta da un corpo
m = massa del corpo
c = calore specifico
Δt = variazione di temperatura
La quantità di calore è proporzionale alla massa e alla variazione di temperatura e, a parità di massa e di variazione di temperatura, è diversa da una sostanza all'altra.
Dalla relazione precedente si può determinare il calore specifico, la cui conoscenza permette di calcolare il calore necessario per portare una certa massa di sostanza da una data temperatura a un'altra.
Cambiamenti di stato
Si veda il paragrafo di chimica.
Scambio termico
Quando abbiamo corpi a temperature diverse, si ha uno scambio termico, cioè il corpo a temperatura maggiore tende a raffreddarsi mentre quello a temperatura minore si riscalda finché non si raggiunge la medesima temperatura. Questo fenomeno è noto come principio dell'equilibrio termico: un sistema è in equilibrio termico quando tutti i suoi punti si trovano alla stessa temperatura. Il riequilibrarsi delle temperature dimostra che è avvenuta una trasmissione o una propagazione del calore tra un corpo e l'altro.
Si possono distinguere tre meccanismi di scambio termico: conduzione, convezione, irraggiamento.
Conduzione
 Lo scambio termico mediante conduzione avviene nei corpi solidi in contatto reciproco.
Lo scambio termico mediante conduzione avviene nei corpi solidi in contatto reciproco.
La vibrazione degli atomi nella zona (o corpo) a maggiore temperatura si trasmette, cioè viene parzialmente ceduta, a quelli a minore temperatura, fino a giungere all'equilibrio termico, senza alcun movimento macroscopico di materia.
L'intensità dello scambio termico tra due zone A e B è direttamente proporzionale all'area S della sezione del conduttore, all'intervallo di tempo Δt considerato, alla differenza di temperatura ΔT tra i due punti, è inversamente proporzionale alla lunghezza x del conduttore e dipende dalla natura del conduttore.
Queste considerazioni intuitive sono espresse dalla legge di Fourier (fisico francese Jean Baptiste Joseph Fourier 1758-1830):
Il coefficiente k dipende dalla sostanza di cui è fatto il corpo e prende il nome di coefficiente di conducibilità termica.
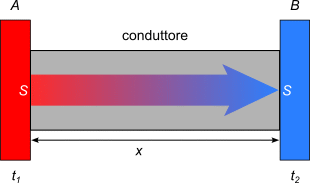
I metalli sono buoni conduttori perché l'agitazione termica si trasmette rapidamente alle altre particelle, mentre le sostanze non metalliche, come le rocce, sono dei cattivi conduttori. Se non trasmettono calore sono isolanti perché, anche se aumenta l'agitazione termica, comunicano in misura limitata le vibrazioni alle particelle vicine. In genere i liquidi e i gas sono pessimi conduttori perché, soprattutto i gas, hanno le particelle lontane tra loro e raramente si urtano.
Convezione
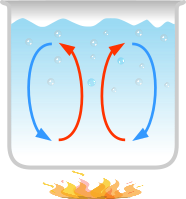 Nei fluidi lo scambio termico avviene per convezione che comporta un trasporto di materia, che non si verifica nei solidi.
Nei fluidi lo scambio termico avviene per convezione che comporta un trasporto di materia, che non si verifica nei solidi.
Un liquido o un gas riscaldato diventa meno denso del materiale circostante (aumenta l'energia cinetica media → aumenta l'ampiezza delle oscillazioni → aumenta la distanza media tra le particelle) e tende a salire per il principio di Archimede, mentre il suo posto è occupato da materiale più denso e freddo che scende. Si crea così una cella convettiva, che è un meccanismo di trasporto del calore molto efficace.
Irraggiamento
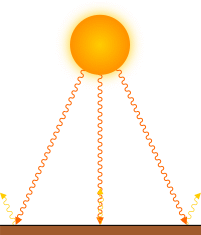 I corpi caldi emettono onde elettromagnetiche, che si trasmettono anche nel vuoto e senza contatto tra loro, e sono analoghe a quelle della luce, ma a frequenza inferiore (raggi infrarossi). Tra i due corpi si ha quindi un trasferimento di energia da quello più caldo a quello più freddo, ma la trasmissione avviene in entrambe le direzioni, ma con minore intensità da parte del corpo più freddo.
I corpi caldi emettono onde elettromagnetiche, che si trasmettono anche nel vuoto e senza contatto tra loro, e sono analoghe a quelle della luce, ma a frequenza inferiore (raggi infrarossi). Tra i due corpi si ha quindi un trasferimento di energia da quello più caldo a quello più freddo, ma la trasmissione avviene in entrambe le direzioni, ma con minore intensità da parte del corpo più freddo.
La legge di Stefan-Boltzmann (fisici austriaci Ludwig Eduard Boltzmann 1844-1906 e Josef Stefan 1835-1893) afferma che l'energia complessiva emessa da un corpo [nero] per unità di superficie e di tempo è proporzionale alla quarta potenza della temperatura assoluta del corpo stesso:
q = σ T4
q è l'emittenza termica
σ è la costante di Stefan-Boltzmann
Dilatazione termica
Un corpo riscaldato aumenta le sue dimensioni e, viceversa, se raffreddato si contrae.
Questo accade perché le particelle, aumentando (o diminuendo) l'agitazione termica e quindi l'ampiezza delle loro oscillazioni, si ha un aumento (o diminuzione) delle loro distanze medie.
Questo fenomeno è sfruttato per la costruzione dei termometri.
Dilatazione lineare
Se un corpo è di forma allungata, come un filo, un'asta, una lunga sbarra, la dilatazione riguarda principalmente la lunghezza (dilatazione lineare).
Prendiamo un'asta di lunghezza l0 alla temperatura t0 e la riscaldiamo. Questa subisce un allungamento Δl per l'aumento di temperatura Δt, proporzionalmente alla lunghezza iniziale e alla variazione di temperatura e dipende dal materiale di cui è composta.
Δl = λ l0 Δt
λ è il coefficiente di dilatazione lineare, determinato sperimentalmente. Nei metalli il coefficiente più alto è dello zinco e il più basso nel platino.
La lunghezza finale è quindi:
l = l0 + Δt = l0 + λ l0 Δt
l = l0(1 + λ Δt)

Dilatazione volumetrica
Consideriamo ora un cubo omogeneo (isotropo) o altro solido con coefficiente di dilatazione lineare λ. In questo caso la dilatazione riguarda le tre direzioni spaziali (dilatazione cubica o volumetrica).
Dopo il riscaldamento, il volume del cubo diventa:
V = [l0(1 + λ Δt)]3
Sviluppando, semplificando e trascurando λ2 e λ3, essendo λ molto piccolo, otteniamo:
V = V0(1 + 3λ Δt)
Dalla relazione si nota che il coefficiente di dilatazione cubica - che si indica con K - è 3 volte quello della dilatazione lineare.
K ≈ 3λ

Per i liquidi la relazione per calcolare la dilatazione volumetrica (non esiste quella lineare) è la medesima di quella dei solidi, ma con coefficienti di dilatazione più elevati.
L'acqua, rispetto alle altre sostanze, ha un comportamento anomalo: tra 0 °C e 4 °C ha un coefficiente di dilatazione negativo, cioè si contrae invece di dilatarsi. Ciò comporta che la massima densità è a 4 °C, con conseguenze importanti per la vita marina e non solo. Sui fondali oceanici la temperatura ha dunque quel valore (trascurando la concentrazione salina) e se si raffredda ulteriormente tende a risalire. Così il ghiaccio, che è meno denso dell'acqua, può galleggiare e sciogliersi con la bella stagione. Se si comportasse come le altre sostanze si accumulerebbe sul fondo e non potrebbe mai sciogliersi.
La dilatazione termica ha un ruolo molto importante nell'evoluzione del paesaggio. Le rocce, che sono composte da minerali diversi, sono anisotrope e perciò, quando sono riscaldate dai raggi solari, non di dilatano in modo uniforme e ciò comporta la loro disgregazione (termoclastismo).
Dilatazione nei gas
Si veda il paragrafo di chimica relativo alle leggi dei gas.

